机器学习助力基因药物研发
通过“阅读基因组”(read genome)解读机体遗传密码,来预测特定基因对应的表型或疾病发生的风险,在了解疾病致病机制及靶向疗法的开发中发挥着重要作用。
为了实现“阅读基因组”,一种超越人脑的分析设备即人工智能(AI)应用而生。
Deep Genomics
Deep Genomics是一家致力于推动AI应用于基因药物(genomic medicine)开发的初创公司,其于2015年由具有机器学习和基因组医学交叉背景的Brendan Frey教授创立,总部位于加拿大多伦多,是北美发展较快的技术公司之一。

从成立至今,Deep Genomics一直专注于使用机器学习来分析DNA或RNA分子水平上的变化,挖掘这些变化与特定疾病的因果关系,帮助研究人员高效、快速地筛选候选药物。
Deep Genomics的AI工作坊
预测细胞分子表型的模型
Deep Genomics的研究人员遵循一种他们认为更强大的机器学习的方法:首先对计算模型进行训练使其可以预测细胞中间变量(intermediate cell variables)也称为分子表型(molecular phenotypes)的变化,然后将这些变量与疾病表型联系起来。
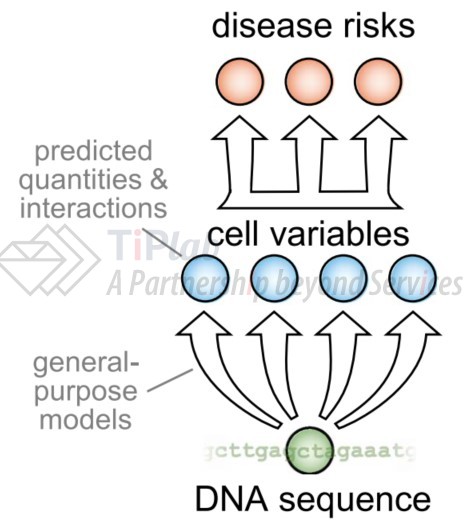
该模型可以预测由一段DNA序列决定的基因型是如何影响细胞变量的,由于细胞中一种变量往往与其他变量相互影响(如细胞内某种蛋白质的浓度对应其基因转录本的浓度),因此可以探索靶向这些细胞变量的针对性疗法。
US10185803B2
针对该模型,2015年6月15日,Deep Genomics递交了美国申请,目前已经获得专利权:US10185803B2。
US10185803B2的权利要求1为:

保护一种用于计算一个或多个遗传变体的一个或多个条件特定的细胞变量由一组变量引起的变化的计算机实现的方法,该方法包括:
a.从DNA或RNA变体序列中提取一组变体特征;
b.使用包含深度神经网络的细胞变量预测器(CVP)处理变体特征;
c.从DNA或RNA参考序列中提取一组参考特征;
d.使用CVP处理参考特征;
e.生成由一组变量诱导产生的一个或多个条件特定的细胞变量的变化。
US10185803B2中公开的方法可以用于确定因变异而引起细胞变量发生的变化,进一步可以通过提取变体特征或修饰变体,以便匹配或开发针对细胞变量变化的疗法。
剪接计算模型
在过去的几年中,Deep Genomics团队的工作集中在开发精确的剪接计算模型,研究遗传变异对DNA剪接的影响。
该技术的思路是建立一个数学模型,通过导入健康人的DNA和RNA序列对模型进行训练,让它学习健康人DNA的剪接模式,并使用分子生物学方法检测模型,加以校正。该模型能够准确地对疾病的变异进行分类,并提示异常剪切对疾病的影响的因果关系。
在开发计算模型的同时,Deep Genomics也递交了多项专利申请对其进行保护。比如:
US20190073443A1
US20190073443A1 涉及一种用于使用生物序列产生用于机器学习的扩展训练集的方法。
US20190220740A1
US20190220740A1 涉及一种在分子表型卷积神经网络(MPCNN)中对卷积层加权的系统。
US20190220740A1中公开的神经网络将生物学序列如DNA、RNA或蛋白质序列等信息作为输入,卷积神经网络对信息进行处理(卷积实际上是一种数学运算,我们可以把卷积想象成一种通过某种规则处理信息的流程),输出是分子表型如剪接模式等,产生的分子表型可用于基因测试、识别药物靶标及确定患者患病风险等。
US20190138878A1
US20190138878A1涉及一种使用分子表型神经网络(MPNN)确定参考生物序列中至少一个取代的每个变体得分的方法。
US20180165412A1
US20180165412A1涉及一种用于连接源自生物学序列的两个或多个生物相关变体的系统。
US20180165412A1中公开的系统包含分子表型神经网络(MPNN)、特征检测器(feature detectors)、输出层(output layer)和比较器(comparator),其中MPNN处理生物相关变体得到代表变体的特征值,feature detectors获取该特征值,进而从output layer输出生物变体的分子表型值,然后comparator加工表型值以确定不同变体间的连接距离。
该连接距离可以将已知或参考变体与其他变体相关联,有助于其他变体的后续的分析解释,及针对性靶向疗法的开发。
综上可知,Deep Genomics递交的专利(申请)集中在使用机器学习分析/预测遗传变量或是执行上述分析/预测的方法/系统,其后续是否能授权以及授权的范围值得我们进一步关注。
从技术走向产品
2019年9月25日,Deep Genomics宣布其AI工作坊在18个月内完成了威尔逊病(Wilson disease)的治疗靶标的确定及后续候选药物筛选的工作。
威尔逊病的治疗靶标
威尔逊病(Wilson disease)是一种危及生命的罕见遗传病,有关研究团队如密歇根大学Frederick K. Askari小组研究了二十多年依然没能揭示其相关的致病机制。
Deep Genomics的AI系统扫描了2400多种疾病和100000多个致病基因突变,分析预测得到的数据,最终确定Met654Arg突变是威尔逊病的致病机制之一。
Met654Arg突变导致机体铜结合蛋白ATP7B功能缺失,进而导致铜在肝脏和中枢神经系统中积累,引起肝脏损伤及精神症状。
DG12P1
确定Met654Arg突变后,Deep Genomics继续使用其AI系统,从数千种化合物中筛选出12种先导化合物,经过耐受性试验之后,确定能够纠正Met645Arg的外显子跳跃机制的DG12P1为针对威尔逊病的理想候选药物。
DG12P1是首款通过AI筛选的药物候选物,其将会被很快地进行相关的临床试验,以便早日惠及患者。
WO2019161105A1
2019年2月14日,Deep Genomics递交了涉及针对威尔逊病的寡核苷酸疗法的国际申请PCT/US2019/018076(公开号:WO2019161105A1)。
WO2019161105A1公开了一种反义寡核苷酸,其包含与靶向ATP7B 6号外显子、ATP7B 6号外显子的5’端内含子、ATP7B 6号外显子的3’端内含子或ATP7B 6号外显子及其5’和3’端内含子序列至少70%互补的序列。
该申请提供的反义寡核苷酸可用于调节ATP7B mRNA的分子水平以达到治疗威尔逊病的目的。
结语
通过AI智能平台可以快速、高效地确定疾病相关靶标,筛选候选化合物,其正在迅速地改变药物研发的历程,而针对该领域的知识产权也需紧跟发明的步伐,构建相应的专利壁垒,以保障今后的市场竞争优势。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
