Tubulis 于 2019 年从柏林FMP研究所和慕尼黑LMU大学分离出来,旨在拓展 ADC 在癌症和其他疾病治疗中的潜力。Tubulis的ADC技术基于 Christian Hackenberger 教授(FMP)、Heinrich Leonhardt 教授(LMU)和 Jonas Helma-Smets 博士研究小组的科学发现,他们均为公司联合创始人。Tubulis已经和BMS和Gilead达成了合作,共同开发ADC药物。
Tubulis的技术平台主要包括三种技术:
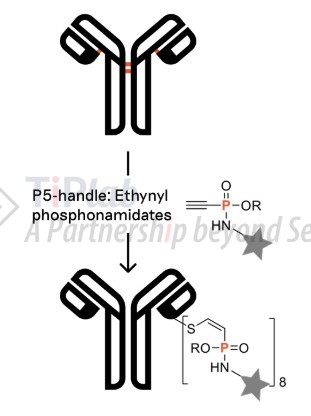
- P5 缀合技术(乙炔基膦酰胺接头偶联)
- 下一代半胱氨酸缀合平台,可产生均质且亲水性的高 DAR ADC,与标准马来酰亚胺偶联系统相比,P5 在血清中具有更优异的连接稳定性。
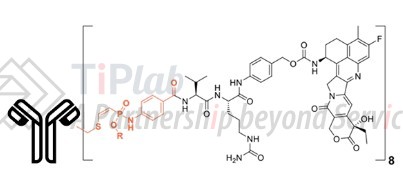
- Tubutecan(基于exatecan的linker-payload)
- 包括乙炔基膦酰胺(P5 缀合)、蛋白酶裂解位点(VC-PAB)和强效拓扑异构酶 1 (TOP1) 抑制剂 exatecan。其在血清中的稳定性优于已获批的基于 TOP1 抑制剂的 ADC Enhertu 和 Trodelvy,且 exatecan 在肿瘤中的暴露量增加了一倍。Tubutecan可以用来连接不同的抗体,在临床前模型中表现出持久的抗肿瘤效果。
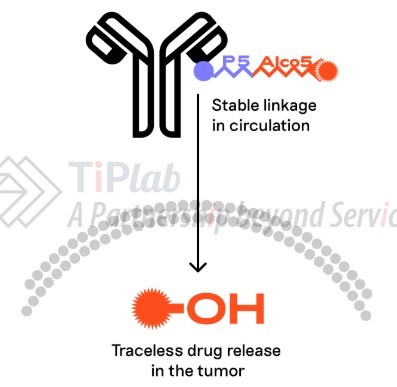
- Alco5(payload缀合技术)
- 能够实现含羟基有效载荷(包括多种细胞毒素和蛋白质降解剂)的稳定缀合和有效的肿瘤内释放。当前的-OH payload连接子受限于稳定性不足,Alco5 能够解决这个问题,已实现 SN38 的稳定偶联。Alco5可以与P5技术同时使用。
Tubulis的两款主要候选药物 TUB-030 和 TUB-040,分别靶向肿瘤相关抗原 5T4(用于治疗多种实体瘤)和 NaPi2b(在卵巢癌和肺癌中高表达),均使用Tubulis 专有的 Tubutecan 技术和 P5 偶联技术。
TUB-030采用乙炔基膦酰胺偶联化学方法将exatecan通过可切割的连接子与靶向 5T4 的人源化 Fc 沉默 IgG1 抗体连接,均质 DAR 值为 8。
TUB-040采用乙炔基膦酰胺偶联化学方法将exatecan通过可切割的连接子与靶向 NaPi2b的人源化 Fc 沉默 IgG1 抗体连接,均质 DAR 值为 8。
TUB-040的临床结果表明 Tubutecan 平台候选药物已获得临床概念验证,并证实了 NaPi2b 是一个颇具吸引力的新型 ADC 靶点。
FMP研究所和LMU大学递交的PCT/EP2017/071937家族涉及炔烃和烯烃-膦酰胺的硫醇偶联物或其偶联方法,即P5偶联技术,在中美均已获得授权。
Tubulis递交的专利涉及平台技术或具体产品,比如:
同一天递交的PCT/EP2022/081345和PCT/EP2022/081371家族涉及Tubutecan技术,权利要求中限定偶联物的结构通式。
同一天递交的PCT/EP2023/079017家族和PCT/EP2023/079019家族均涉及新型抗NaPi2b抗体、包含该抗NaPi2b抗体的ADC以及治疗方法和用途等。
PCT/EP2023/079070家族涉及新型抗-tpbg(5T4)抗体和基于其的ADC、其治疗方法及用途。
PCT/EP2024/074322家族涉及膦酰胺化合物的制备方法,能够高效安全合成膦酰胺。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
