Acular® 0.5%
Acular® 0.5%的诞生
上世纪70年代早期,Syntex SA (1994年并入罗氏旗下)的科学家们发明了一种非甾体抗炎药(NSAID)–酮咯酸(酮咯酸氨丁三醇),其随后被美国FDA批准用于作为强效镇痛药。Syntex获得了保护这一发明的若干专利,分别涉及:该化合物本身的新化学实体(NCE)、用该化合物治疗严重疼痛的用途和该化合物的制备方法。
随后,人们继续对这个化合物的性质和潜在的医药用途进行研究,并发现,可以通过局部施用该化合物来治疗某些眼疾。相应地,Syntex又获得了一个新的专利,保护用包含酮咯酸氨丁三醇的局部制剂来治疗眼疾的这个新用途。为了把这个新的用途与产品结合起来,他们继续尝试把这个化合物加到眼药水的配方中使用。然而,事情进展得并不顺利,研究人员们一直没找到可靠、稳定的制剂解决方案。Syntex的制剂专家们花费了数年时间,进行了成百上千次尝试。终于,功夫不负有心人,他们发现,通过使用一种特殊的稳定剂可以很好地解决这个问题。基于此发明,Syntex获得了另一个专利,保护包含这种特殊稳定剂的酮咯酸氨丁三醇眼用制剂。
1992年11月9日,FDA批准了Acular® 0.5% 这个眼药水产品,在FDA的橙皮书中一共列出了三个与此药相关的专利,如下图所示:
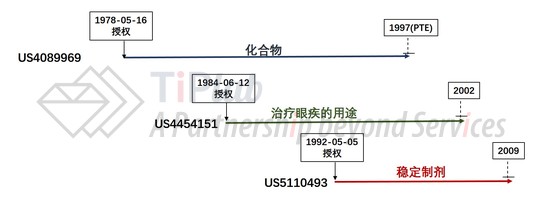
可以看到,保护药品活性成分(化合物本身)的专利US4089969因受惠于专利期延长,将于1997年到期,保护治疗眼疾的医药用途的专利US4454151于2002年到期,而保护稳定制剂的专利US5110493于2009年到期。因为US4089969的专利保护期已被延长,对于涉及后续改进的专利US4454151和US5110493将无法再要求延长专利保护期(PTE)。
在市场独占期方面,由于原研药企业根据FDA的要求开展并完成了儿科用药的相关研究,Acular® 0.5%获得了6个月的儿科独占期延长。由于采用了新的制剂并针对新的适应症,Acular® 0.5%还获得了3年的市场独占期。上世纪九十年代,原研药企业开展了利用Acular® 0.5%进行的针对孤儿药适应症(白内障手术后的炎性反应)的临床研究,并于1998年获批用于该孤儿药适应症,且相应地获得了7年的孤儿药独占期(仅适用于白内障手术后的炎性反应这一适应症)。
综上,围绕Acular® 0.5%的专利保护期与市场独占期的相互关系如下图所示。
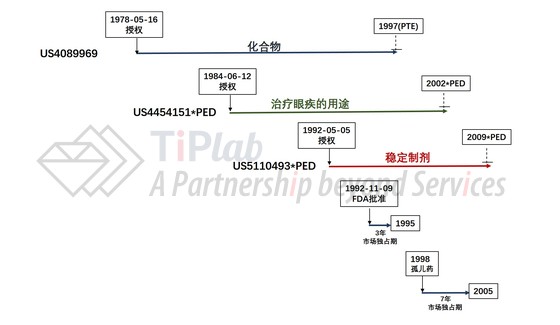
可见,如果没有专利保护,Acular® 0.5%将于1995年失去市场独占权,即使加上6个月的儿科用药独占期,也将于1996年失去市场独占权(孤儿药适应症除外)。针对孤儿药适应症,如果没有专利保护,Acular® 0.5%将于2005年失去市场独占权。也就是说,如果完全没有专利保护,用于非孤儿药适应症的仿制药将在1996年就能够上市销售了,比最终的2009年早了整整13年。
那么如果只有保护化合物的专利,情况又是怎么样的呢?如果只有保护化合物的专利,即使算上专利期延长(PTE),Acular® 0.5%也将在1997年失去独占权(孤儿药适应症除外)。换言之,如果没有保护后续改进的两个专利,用于非孤儿药适应症的仿制药将在1997年就能够上市销售了,比最终的2009年早了整整12年。
可见,除了保护药物活性成分的专利外,保护后续改进的一系列专利(例如,针对改进的制剂、新的医药用途等)对于延长药品生命周期也将起到至关重要的作用。
来自Apotex的挑战
2001年,来自加拿大的仿制药公司Apotex递交了针对Acular® 0.5%的ANDA申请。Apotex的ANDA申请仅涉及非孤儿药适应症,因为针对孤儿药适应症的市场独占权要到2005年才到期。在ADNA申请中,Apotex同时递交了第IV段声明,认为橙皮书中列出的保护制剂的专利US5110493无效,且仿制药不侵权。
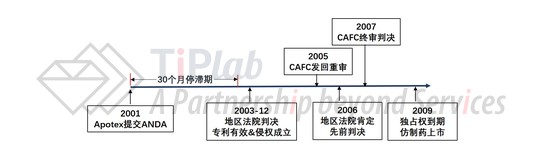
面对Apotex的ANDA申请,原研药企业(Allergan,其从Syntex许可获得了Acular®的相关权利)果断在45天的规定时间内向地区法院提出了针对Apotex的专利侵权诉讼。相应地,Apotex的ANDA申请自动进入30个月的停滞期。也就是说,从Allergan收到Apotex提出第IV段声明的告知函之日起30个月内(或到法院作出判决时为止),FDA不能批准Apotex的ANDA申请。
旷日持久的专利侵权诉讼一直持续到2003年夏天,眼看30个月的停滞期就要结束了,法院还没有作出最后决定。在Allergan的请求下,法院又将30个月的停滞期延长到了2003年年底,并且终于在2003年12月份判定US5110493专利有效且侵权行为成立(Syntex and Allergan v. Apotex, 2003)。 Apotex表示不服,继续上诉到联邦巡回法院(CAFC),CAFC在2005年作出决定将此案发回地区法院重审以进一步查明事实。2006年,地区法院经查,认为先前的判决没有错误,而CAFC也于2007年认可了地区法院第二次作出的决定。Apotex仍不死心,希望最高法院能够提审此案,但是最高法院拒绝了这个请求,于是本案至此尘埃落定。根据Hatch Waxman法案的相关规定,法院要求FDA在US5110493专利到期+6个月的儿科用药独占权到期前不可批准Apotex的ANDA申请。于是,Apotex折腾了一大圈,也只能乖乖等到2009年专利过期,其仿制药才能上市销售。下图中总结了Apotex与Allergan长达6年(2001-2007)的专利纠葛。
Acular® LS
Acular® LS的诞生
虽然Acular® 0.5%销量不错,但它有个很明显的缺点:使用时会引起眼内短暂的灼烧感和刺痛。为了解决这个问题,Allergan(如上文所述,Allergan从Syntex许可获得了Acular®的相关权利)开始研发一种新的制剂,其中降低了活性成分的浓度(由0.5%降低到了0.4%)却可以保持药效相当,而且显著增加了使用的舒适度。受试者使用后,均表示使用这种改良的制剂后灼烧感和刺痛都减轻了。由于改良制剂的这一功效,Allergan开展了新的临床试验来检测新制剂在缓解Lasik角膜手术后的眼部疼痛和灼痛方面的效果,并随后就这个改进的产品Acular® LS成功获得了FDA批准。升级换代后的Acular® LS于2003年上市,并且在橙皮书里列出的一众专利中,也包括保护稳定制剂的US5110493(正是处于Acular®专利纠纷旋涡中心的那个专利)。此外,基于新的适应症,Acular® LS还获得了3年的市场独占期。
此后不久,Apotex紧紧跟上,仿制了改进后的Acular® LS,并于2004年10月向FDA递交了另一个ANDA申请,且提交了第IV段声明,声称US5110493无效且其仿制药产品不侵权。Allergan这次仍然当机立断,在45天内提起了侵权诉讼(于是触发了30个月的自动停滞期),而双方在之前交战过的地区法院再次交锋。2007年,同一个地区法院作出决定,认定涉案专利有效且侵权行为成立,CAFC于2008年再次认可了地区法院的决定,这时候30个月的自动停滞期也刚刚过。最终,Apotex的仿制药仍然要等到2009年专利过期后才能上市。
让我们来回顾一下Acular® LS的故事,如果没有制剂专利US5110493的保护,Acular® LS的市场独占权将在2006年到期,而稳定的制剂专利权使Apotex的仿制药延后了3年才上市。
Acuvail®
创新在继续
因为预见到Acular®和Acular® LS的仿制药将在2009年专利到期后上市,Allergan早早做了准备,并于2009年7月推出了Acuvail®,这也是一款有专利保护的产品,包含0.45%的酮咯酸、不含防腐剂、为单位剂量剂型。此外,Acuvail含有羧甲基纤维素以改善患者使用的舒适度,其用于治疗白内障手术后的疼痛和炎性反应。所以,从某种意义上来说,Acular®的产品线仍然保持生机,且将至少持续到2029年相关专利到期为止。
Acular®的故事展示了如何综合利用产品的持续创新(化合物、新的医药用途、制剂)、前瞻性专利布局、橙皮书专利披露、专利期延长和四种不同的FDA独占权(新用途、新制剂、孤儿药和儿科用药)来尽量延长药品的生命周期,并且不断为患者提供更舒适、更有效的产品。正是因为进行了积极有效的产品生命周期管理,Acular®的产品线在长达17年的时间中一直立于不败之地。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
