骨质疏松症及其用药现状
骨质疏松症
骨质疏松症(osteoporosis)是一种以骨量(bone mass)降低和骨微结构破坏为特征,导致骨脆弱性增加和易发生骨折的全身性骨病,可分为原发性和继发性骨质疏松两大类。
绝经后妇女骨质疏松是原发性骨质疏松症的一种,患者会表现出腰背或者全身骨痛、严重者会表现脊柱变形、最严重的后果是发生骨折。骨质疏松性骨折发生后,再次骨折的风险会显著增加。
骨质疏松症的用药
骨质疏松是个常见的大众病,全球具有庞大的患者人群。目前治疗骨质疏松症的药物按其作用主要分为三类,分别是:
骨吸收抑制剂:通过抑制骨的吸收来减少骨钙的丢失,包括雌激素替代疗法、雌激素受体调节剂、二磷酸盐和降钙素等;
骨形成促进剂:包括甲状腺旁素等;
骨矿化药物:主要是钙剂,特别是钙及活性维生素D制剂。
本次获批的EvenityTM不仅能够促进骨形成,而且能够减少骨吸收,兼具了骨吸收抑制剂和骨形成促进剂的作用。
抗sclerostin单抗romosozumab
sclerostin(骨硬化蛋白)
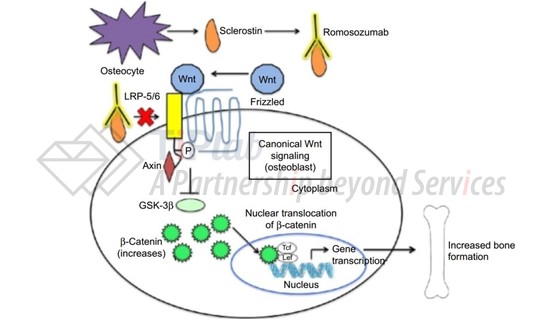
Romosozumab的靶点sclerostin(骨硬化蛋白)又称硬骨素,是由骨细胞(osteocytes)分泌的一种糖蛋白,由SOST(骨硬化蛋白基因)编码,在骨代谢中具有重要作用。
将sclerostin与骨质疏松症联系起来得益于对硬化性骨化病(sclerosteosis)和泛发性骨皮质增厚症(van Buchem’s disease)的研究。这两种疾病都属于常染色体隐性遗传病,且SOST基因均存在突变。
由于SOST基因的异常,患者体内的sclerostin产生量减少,表现全身进行性骨硬化的症状,但这些患者发生骨折的风险非常低,因为他们的骨密度是增加的。
这些科学发现为临床治疗骨质疏松提供了新思路,启发了抗sclerostin抗体的研发。
romosozumab
2003年,来自Celltech R&D(2004年被比利时制药商UCB收购)的研究人员在发表在EMBO杂志上的文章中报道sclerostin在由骨细胞介导的骨重建的过程中发挥着重要的作用,并提出将sclerostin作为治疗骨骼疾患靶点。
2004年,Amgen与UCB达成协议,合作开发针对sclerostin的抗体产品,并于2019年成功地将romosozumab推入市场。
EvenityTM的治疗疗程为每月皮下注射一次,持续12个月,对骨质疏松患者来说,这种给药方式相对比较方便。
当romosozumab进入人体后,能够与sclerostin(骨硬化蛋白)结合,拮抗sclerostin的活性,阻断sclerostin-LRP-5/6通路,促进骨形成并减少骨吸收,从而缓解骨质疏松的症状。
围绕romosozumab的专利保护
针对romosozumab的活性成分、制剂和医药用途等,Amgen/UCB递交了大量的专利申请对其进行了保护。
活性成分专利家族
US7592429B2
2006年4月25日,UCB与Amgen共同递交了一项涉及sclerostin结合抗体的美国申请,授权公告号为US7592429B2,其权利要求1限定了抗体的重链和轻链的序列,并限定了抗体对sclerostin的结合亲和力。
PCT/US2006/016441
2006年4月28日,UCB与Amgen递交了涉及sclerostin结合剂的国际申请PCT/US2006/016441,并进入了包括CN、EP在内的多个国家和地区。 PCT/US2006/016441进入中国国家阶段的专利CN101287756B,其权利要求1为:

限定了抗体的CDR序列,该专利预计2026年4月到期。
CN101287756B分案
在CN101287756B的基础上,UCB与Amgen还递交了一系列分案,如已经获得授权的CN103435698B、CN103819558B均限定了抗体的氨基酸序列;尚处于审查阶段的CN107446043A限定了抗体的结合表位。
可见,Amgen/UCB从抗体本身的序列和抗体结合的表位等范围对抗体进行了保护,构建起保护抗体活性成分的专利家族。
医药用途专利家族
2008年9月17日,Amgen同一天递交了涉及抑制骨吸收方法的国际申请PCT/US2008/076679和目前已经获得授权的美国专利US8017120B2。
US8017120B2
US8017120B2的权利要求1涉及向需要的人施用抗sclerostin抗体的方法,限定了抗体的施用剂量、抗体的CDR序列、抗体结合的sclerostin序列及抗体对sclerostin的亲和力。
US8440193B2
US8017120B2的分案US8440193B2的权利要求1为:

涉及一种抑制人体骨吸收的方法,限定了抗体的施用剂量、抗体的CDR序列、抗体结合的sclerostin序列及抗体对sclerostin的亲和力,并限定了骨吸收是被抑制的。
PCT/US2012/068975
2012年12月,Amgen递交了涉及使用抗sclerostin抗体治疗牙槽骨流失的国际申请PCT/US2012/068975。
PCT/US2012/068975对应的美国授权的专利US9657090B2涉及一种治疗牙槽骨流失的方法,包括向受试者施用抗sclerostin抗体,剂量为每周约5 mg至约1000 mg,并限定了抗体重链和轻链的CDR序列。
PCT/US2012/068975进入中国国家阶段的专利申请CN107126560A,其权利要求1为:

涉及一种向受试者施用抗骨硬化蛋白抗体治疗受试者牙槽骨流失的方法,限定了每周抗体的施用剂量。
CN107126560A的权利要求1请求保护的范围相对比较宽泛,该申请目前处于审查阶段,尚未获得授权。
上述专利(申请)保护的适应症与FDA批准的说明书中的适应症不一致,推测后续可能会递交相应适应症的上市申请。
抗体制剂专利家族
2011年5月,Amgen递交了涉及抗体制剂的国际申请PCT/US2011/036062。
PCT/US2011/036062对应的美国专利US9352043B2,涉及一种无菌液体制剂,限定了制剂的组成成分。US9352043B2的权利要求1的保护范围不涵盖FDA批准的说明书中romosozumab的制剂。
US9352043B2的延续案US10064946B2的权利要求1为:

限定为一种无菌液体制剂,其绝对粘度约为10 cP或更低,基本上由约70 mg/mL至约200 mg/mL的抗sclerostin免疫球蛋白、约5 mM至约15 mM的钙、约10 mM至约90 mM的乙酸盐组成,并限定了免疫球蛋白的氨基酸序列。
US10064946B2的权利要求1的保护范围涵盖FDA批准的说明书中romosozumab的制剂。
结语
除EvenityTM之外,Amgen已经上市了骨质疏松症重磅药物Prolia®(denosumab, 靶向RNAKL的IgG2单抗)。针对denosumab,Amgen也构建了保护抗体活性成分、生产方法和医药用途等方面的专利申请。
EvenityTM能增加骨折患者的骨密度并降低骨折的风险,在完成EvenityTM的治疗疗程后,患者可以选择使用Prolia®继续治疗。因此EvenityTM可以被认为是Prolia®有力的继任者。
Prolia®于2010年首次被FDA批准用于治疗绝经后妇女骨质疏松症,2018年FDA又批准了其用于治疗成人糖皮质激素诱导的骨质疏松症。
可见,针对已经上市的药物,Amgen继续寻求扩大产品的适应症,以提高产品在其生命周期中的价值。同时继续创新,推出更好的产品并对其进行专利布局,保持自身在领域内的竞争优势。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
