在胰岛素界称霸一方的Lantus®
称霸江湖15年的甘精胰岛素Lantus®
Lantus®的活性成分为甘精胰岛素,是一种人工合成的长效胰岛素,其自2000年经美国FDA批准上市以来,取得了巨大的成功,销量节节攀升。 在长达15年的时间里,Lantus®在胰岛素界称霸一方。
现如今,Lantus®是赛诺菲门下当之无愧的超级明星。近年来,赛诺菲每年营收的近1/5来自Lantus®。在糖尿病领域,虽然赛诺菲拥有众多产品,但作为胰岛素界霸主的Lantus®以超过70亿美元的峰值年销售额为赛诺菲贡献了糖尿病领域内80%以上的营收。
然而,随着保护Lantus®的核心专利于2015年到期,其前景被蒙上了一层阴影。
为Lantus®保驾护航的专利们
对于防范竞争对手而言,最有力的武器当然是保护甘精胰岛素这一活性成分的化合物专利。然而,其在美国的核心专利US6100376和US5656722已分别于2010年5月6日和2015年2月12日到期。
位于第二阵线的是保护甘精胰岛素稳定制剂组合物的专利,其中包括US7476652(2024年1月 23日到期)和US7713930(2023年12月13日到期),这两个专利也是仿制药企业很难规避的。
对于Lantus®这样的产品来说,施用和递送设备也是非常关键的,将直接影响患者的使用感受和忠诚度。因此,赛诺菲也拥有众多专利来保护注射和递送装置。这一系列专利将陆续于2024年至2028年到期,其中最晚到期的是US7918833,将于 2028年3月23日到期。
我们在下图中尝试总结了用于保护Lantus®的主要专利。

Toujeo®
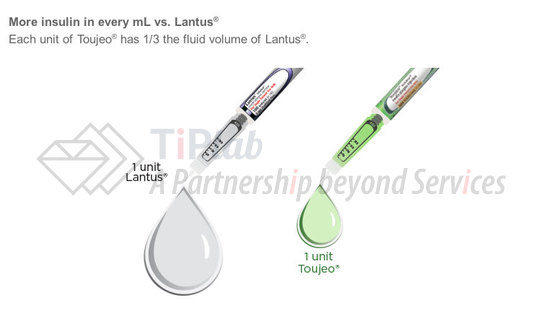
作为产品生命周期管理中最常用的手段之一,企业通常会在重要产品的核心专利到期之前推出“第二代”的改良版本,以期部分患者能够转而使用改良后的“原研”药品,从而减少仿制药上市带来的冲击。
赛诺菲也不例外,他们加班加点研发出了Lantus®的加强版Toujeo®。Toujeo®于2015年2月25日获得FDA批准上市销售,而此前2周,Lantus®的核心专利刚刚到期。Toujeo®中甘精胰岛素的浓度是Lantus®的三倍,可谓一滴顶三滴,大概率会成为很多医生和患者的优选产品之一。
同样地,Toujeo®也有众多专利傍身,这些专利将于2024年至2031年陆续到期,其中较晚到期的是US9345750,其保护包含300 U/mL甘精胰岛素的液体制剂,以及皮下施用该液体制剂来治疗糖尿病的方法,可以被视为是Toujeo®的核心专利之一。
竞争对手摩拳擦掌,仿制药冲击不可避免
早在Lantus®的核心专利到期前,竞争对手们就开始磨刀霍霍,纷纷准备好自己的仿制药来跟Lantus®一较高下。
礼来/勃林格殷格翰队拔得头筹
15年前,礼来在糖尿病领域的霸主地位被赛诺菲用Lantus®夺走了。15年后,礼来蓄势待发,与BI组队,在Lantus®的核心专利到期前夕争分夺秒地抢占首仿的席位。礼来/BI队从2011年开始推进代号为LY2963016的产品的临床试验,并于2013年欢欢喜喜地递交了自己的NDA申请(注: 由于一些历史原因,礼来不是通过351(k)途径递交的BLA,而是通过505(b)(2)途径递交的NDA)。在NDA申请中,礼来针对橙皮书中所列的专利提出了Par IV声明,即认为这些专利无效/不可实施,和/或自己的产品不侵权。
就此,礼来与赛诺菲的正面交锋正式拉开帷幕。
赛诺菲在规定的时间内提起了针对礼来的专利侵权诉讼,相应地,礼来NDA申请的批准被自动延迟了30个月。本次纠纷涉及到的专利一共有7个,大体上分为两个阵营:第一个阵营的专利保护甘精胰岛素稳定制剂组合物,其中包括US7476652(2024年1月 23日到期)和US7713930(2023年12月13日到期);第二个阵营的5个专利保护施用和递送设备,将陆续于2024年至2028年到期,其中最晚到期的是US7918833 (将于2028年3月23日到期)。
双方酣战几个回合后,于2015年10月握手言和,根据和解协议,礼来的仿制药Basaglar在2016年12月15日前不得在美国市场出售。Basaglar原本在2014年8月就获得了美国FDA的预批准,但上市时间却向后推迟了2年多,直到2016年12月,可见Lantus®专利武器的威力。
尽管上市之路阻碍颇多,但礼来的Basaglar仍然是Lantus®称霸多年后的第一个正面对手,开始逐步改变甘精胰岛素领域的竞争格局。
默沙东/三星Bioepis队紧随其后
继礼来之后推出Lantus®仿制药的是默沙东/三星Bioepis队。默沙东于2016年8月首次递交了NDA申请(也是505(b)(2)途径),并在今年6月递交了第二个NDA申请,这两个NDA申请所涉及产品的包装方式和规格略有不同。跟礼来一样,默沙东在其NDA申请中也针对橙皮书中所列的专利提出了Par IV声明,即认为这些专利无效/不可实施,和/或自己的产品不侵权。
于是,自2016年9月起,赛诺菲又开始了与默沙东的专利大战。此次纠纷涉及到的专利一共有10个,除上次与礼来的交锋中曾经出场的7员大将外,又添加了3个保护施用和递送设备的专利。而默沙东NDA申请的批准,同样因专利诉讼被自动延迟了30个月。因此,虽然默沙东已于2017年7月获得了美国FDA的预批准,其产品正式上市估计要等到2019年春天了。到那个时候,礼来的Basaglar已经卖了2年多了,而礼来在糖尿病领域本来就实力不俗,所以留给默沙东的机会并没有太多。
Mylan/Biocon队摩拳擦掌
参与这场瓜分Lantus®市场份额的角逐的,还有Mylan/Biocon队。虽然Mylan还没有向美国FDA提出NDA申请,但是根据其仿制药在其它国家和地区的进展,估计很快就会在美国采取相关行动。
实际上,Mylan已经提前在美国开始扫除障碍的活动了。
今年6月份,Mylan向PTAB提出了2个IPR请求,分别请求无效赛诺菲的专利US7476652(2024年1月 23日到期)和US7713930(2023年12月13日到期)。这两个专利保护的都是甘精胰岛素的稳定制剂组合物,在赛诺菲与礼来及赛诺菲与默沙东的大战中都曾是冲锋陷阵的大将。Mylan挑战的理由主要是这些组合物的配方显而易见,所以专利不具备创造性。如果Mylan的挑战成功,无疑会为其自己的仿制药后续在美国上市扫除一些障碍。此外,这两个IPR请求也在一定程度上为默沙东助了一臂之力,使各方博弈的局面产生了微妙的变化。
我们在下图中总结了甘精胰岛素江湖中的各方势力这些年来的恩恩怨怨。

甘李趁机出海
提到甘精胰岛素,有一个中国企业不得不提,那就是甘李药业和其门下的重要产品长秀霖®(Basalin®)。
鉴于Lantus®在美国的核心专利将于2015年到期,甘李的长秀霖也欲借机走出中国,打入美国市场。2015年,甘李在美国开始了长秀霖的I期临床试验,预期将在2019年年底完成III期临床试验,并在2020年向FDA提出上市审批申请。
如果Mylan成功无效保护Lantus®稳定制剂的专利US7476652(2024年1月23日到期)和US7713930(2023年12月13日到期),无疑也会为甘李进军美国市场铺平道路。
可见,随着甘精胰岛素的核心专利于2015年到期,赛诺菲门下的超级明星Lantus®面临着来自多个仿制药的威胁,江湖地位岌岌可危。虽然新一代胰岛素类产品Toujeo®的推出以及一系列外围专利的保护也许可以为赛诺菲争取一些时间寻找转机,但是,毫无疑问,胰岛素的江湖即将迎来新的时代。在这一轮竞争中,礼来明显已占了先机,默沙东和Mylan紧随其后,而中国企业甘李也抓住了机会 ,以期打开新的局面。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
