AOC 1001的组成和治病机理
首先介绍一下AOC 1001的组成和治病机理。
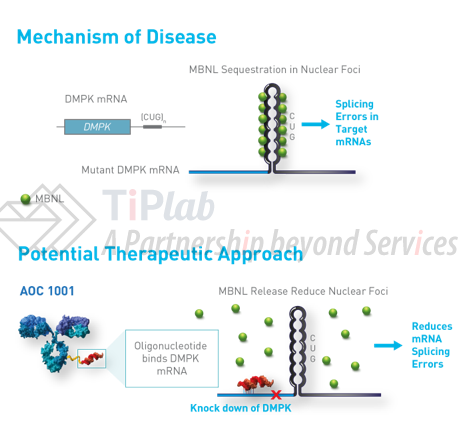
AOC由能够结合转铁蛋白受体1(TfR1)的单克隆抗体和靶向DMPK mRNA的小干扰RNA(siRNA)结合而成,其目标适应症为一种神经肌肉疾病——1型强直性肌营养不良(DM1)。DMPK属于一类可以调节与肌萎缩相关的基因,该类基因可以统称为atrogene。 DM1由DMPK mRNA中的CUG三联体复合物引起。
AOC 1001的TfR1抗体部分可以结合骨骼、心脏和平滑肌等细胞表面的TfR1,引起细胞内吞,将缀合其上的siRNA递送至细胞内部,使得siRNA靶向细胞核中的DMPK mRNA,从而降低DMPK mRNA以及CUG水平。这就是AOC 1001的治病机理。
从专利作用的角度出发考虑布局
我们希望专利策略能够服务于商业目标,为企业带来商业价值。在专利布局时,一般可以从以下两个层次考虑专利所要实现的商业价值:
- “我的商业化产品/技术是什么?”
因为我希望专利能够直接保护未来的商业化产品/技术,从而阻止别人商业化和我的产品完全相同的产品,这种相同结构的竞品对我商业利润的损害是最大的。
- “我的竞品可能是什么?”
因为我希望专利能够涵盖和我的产品类似的产品,从而能够阻止别人模仿我,开发和我类似的产品,或者尽可能大地增加竞争对手的模仿成本。
AOC 1001在进行专利布局时,在不同的技术角度都考虑了上述两个层次的保护策略。
Avidity先后递交了三个PCT国际申请——PCT/US2018/064359(PCT申请1),PCT/US2021/024303(PCT申请2)和PCT/US2019/068078(PCT申请3),并由此在其主要市场美国衍生出多个延续案或分案申请,不仅保护了与AOC 1001直接相关的包含靶向DMPK mRNA的siRNA和TfR1全长抗体的conjugate,还保护了靶向同一靶点的ASO、靶向其他atrogene基因的寡核苷酸、或TfR1抗体片段等竞品可能出现的形式,并且涉及从靶区域到序列的差异化保护范围。
PCT申请1专利组合
首先,PCT申请1的布局围绕寡核苷酸靶点展开,衍生于其的美国授权专利US10881743B2(专利1)、US11497814B2(专利2)均保护一种siRNA conjugate,其包含两部分,一部分为靶向DMPK mRNA的siRNA,另一部分为TfR1抗体,但是保护范围并不相同。
其中,专利1并未对靶向DMPK mRNA的具体亚区域进行限定,以功能限定siRNA可以诱导DMPK mRNA干扰,并且限定TfR抗体包含2条轻链可变区(VL)和2条重链可变区(VH),也就是说,包含1条VL和1条VH的单个Fab或scFv形式不包含在专利1的保护范围内。

专利2在寡核苷酸层面进一步限定了siRNA是双链RNA,细化靶区域为DMPK mRNA的外显子1-13,并且不包含CUG重复。专利2在抗体层面则涵盖了抗体或抗原结合片段。

相对来说,专利2的寡核苷酸部分的范围比专利1小一些,抗体部分比专利1的范围稍大一些。这两个专利互相补强了对方缩限的部分,如果对专利1进行规避设计,使用非全长抗体的TfR1抗体,则可能落入专利2的范围,如果对专利2进行规避设计,靶向非外显子1-13的靶区域,则可能落入专利1的范围。
同样衍生自PCT申请1的美国专利US11576980B2、US11246941B2和US11253607B2保护了包含靶向DMPK mRNA的区别于siRNA的ASO和TfR抗体的conjugate,美国专利US11583591B2和US11554176B2则保护了靶向肌萎缩相关基因Murf1的寡核苷酸和TfR1抗体的conjugate。这些专利不仅为Avidity自身未来开发AOC 1001的更新换代产品提供了保障,也有效地阻碍了竞争者。如果竞争对手计划开发ASO形式的AOC或靶向Murf1的AOC作为AOC 1001的竞品,需要慎重考虑是否可能侵犯Avidity这几个专利。
上述专利均从靶点层面进行布局,不仅保护了与商业化产品直接相关的技术方案,还涵盖了有可能成为竞品的技术方案。这种专利常在管线开发早期、具体商业化产品结构特征尚不明确的时候提交申请,期望获得的保护范围大,涵盖的产品形式多,以尽可能地适应未来产品开发的多个方向。
在产品开发后期,当商业化产品的特征逐渐明确时,可以考虑布局针对商业化产品特征的小范围专利,例如,保护产品的序列、修饰方式等。这种专利保护范围相对来说较小,但更为稳定,可以灵活适用于交易许可、药品专利有效期延长等方面。
PCT申请2专利组合
因此,Avidity提交了PCT申请2,从寡核苷酸的序列和修饰的层面更加针对性地保护AOC 1001。衍生自PCT申请2有两个美国授权专利US11446387B2(专利3)和US11707532B2(专利4),主题分别为产品和方法,但限定的技术特征均为siRNA的正义链和反义链的具体序列,SEQ ID Nos: 3, 5, 7, 9, 11, 13 and 15之间、SEQ ID Nos: 4, 6, 8, 10, 12, 14 and 16之间的差异仅在于核苷酸修饰不同。这些核苷酸修饰可能是AOC效果体现的必要特征,当无法获得裸序列的保护范围时,获得序列+修饰的保护范围,以涵盖效果较优的那些,对申请人来说也是有重大价值的。


PCT申请3
我们可以看到,PCT申请1和PCT申请2的布局重点在于寡核苷酸,对于抗体部分未作过多限定。关于TfR1抗体,Avidity通过PCT申请3进行了单独布局。由于TfR1抗体与寡核苷酸的conjugate形式早已是现有技术,因此,针对TfR1进行靶点层面的布局难度较大,序列层面的技术方案的可专利性更高。
对于抗体专利,根据目前主流国家或地区的审查尺度,可接受的范围一般为限定至6个CDR组合,衍生自PCT申请3的两个美国专利US10913800B2(专利5)和US11028179B2(专利6)的授权范围也确是如此,但略有不同。其中,专利5的6个CDR中包含序列通式,例如HCDR2、LCDR1、LCDR2和LCDR3,在某些位置包含了2个氨基酸残基,涵盖不同的6个CDR组合,这种撰写方式相应地扩大了保护范围,避免他人常规替换几个不影响抗体活性的氨基酸就轻易规避。专利6则包含了具体一组6个CDR组合,更贴近产品中的序列。专利5和专利6说明,虽然抗体专利的审查尺度较为明确,申请人也可以通过合理的撰写方式和提供合适的支持数据,在一个专利中保护多个相似序列。


总结
通过上述讨论,我们可以看到,在AOC领域,我们可以从寡核苷酸和抗体两个技术点分别进行专利布局,就每个技术点而言,可以布局从靶点到序列的不同保护范围,从而形成围绕产品的专利组合,不仅保护商业化产品本身,也可以起到阻碍竞品的作用。
从AOC 1001的专利布局来看,衍生自PCT申请1的专利组合考虑了保护产品上位概念和阻碍竞争的角度,用专利1保护涵盖商业化产品的技术方案,用专利2保护来阻碍竞品,防止竞争者做其他的肌萎缩相关基因或其他形式的寡核苷酸;衍生自PCT申请2的专利组合考虑了专利的保护期以及更贴合特定商业化产品的专利保护层次,用专利3和专利4从产品和方法的角度保护包含具体寡核苷酸的产品;上述两组专利均以寡核苷酸作为技术点出发,衍生自PCT申请3的专利组合则从抗体的角度出发,也保护了具体产品以及有可能成为竞品的相似序列的抗体。上述专利组合交织在一起,最大程度地保障技术创新的利益。
那么,在具体实施的时候,为了提高获得不同保护范围专利权的可能性,我们需要做什么样的准备,特别是,从企业的角度,需要提供什么样的实验数据或证明材料,我们将在下一篇文章中继续介绍。
