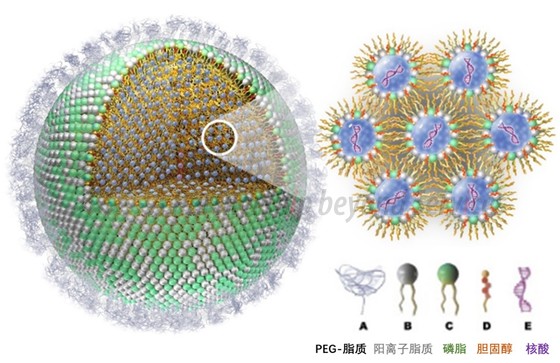
现阶段临床已验证过的LNP组合物主要包括4大组分:阳离子脂质、胆固醇、磷脂及PEG-脂质,其中,阳离子脂质分子大都带有正电,可以通过静电相互作用与带负电的核酸结合,充分包裹核酸分子,促进细胞吸收。
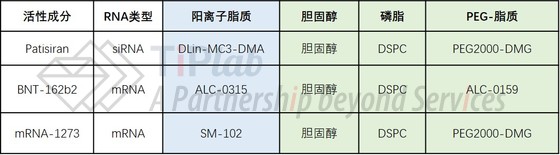
目前,已有4款基于LNP的RNA药物获批,包括:递送siRNA的Patisiran以及递送mRNA的BNT162b2、mRNA-1273和ARCoVax(EUA)。
LNP组合物组分
阳离子脂质是LNP递送系统中最关键的组分,决定了递送效率和转染效率。它有三个重要的结构区域:极性头部(head group)、疏水尾部(hydrophobic tail)以及连接链(linker),这些结构区域对阳离子脂质在内体的递送和转染都具有重大影响(见下图组分B)。
胆固醇在LNP中起到稳定纳米颗粒结构,促进核酸胞内摄入和胞质进入的作用(见下图组分D);
磷脂有助于核酸的封装,支持层状脂质双层结构的形成并稳定其结构排列,还可提高核酸递送效率(见下图组分C);
PEG-脂质是一类脂质(如:DMPE和DMG)和聚乙二醇(polyethylene glycol,PEG)的偶联物,通过改变PEG-脂质的量或混合参数(如流速和体积比)可以调节LNP颗粒的大小。此外,PEG-脂质位于脂质纳米粒表面,能够防止颗粒聚集、提高纳米颗粒整体稳定性,延长纳米颗粒药物在血液中的代谢时间(见下图组分A)。
LNP组合物的发现
1990年,Vical Inc.(现更名为Brickell Biotech)针对DOTMA(永久带电的阳离子脂质)及其合成衍生物DOTAP可单独或与DOPE、DOPC结合用于DNA或mRNA递送的技术方案,递交了相关专利PCT/US1990/001515,该家族已于2010年到期。
其代表性专利为EP0737750B1,权利要求9保护一种组合物,包括带正电荷的脂质与编码免疫原性肽的多核苷酸,用于免疫治疗。

可见,仅限定包含带正电荷的阳离子脂质和可编码的多核苷酸的宽泛组合物方案,早在三十多年前就被Vical公开,目前此类宽泛方案的风险已经消除。
随后,Farhood等人进一步研究了辅助磷脂(如:DOPE)的作用,设计了对比试验,证明与单独使用阳离子脂质制成的制剂相比,辅助磷脂在大多数情况下提高了转染效率和纳米颗粒稳定性。
1999年,Inex Pharmaceuticals的科学家(Pieter Cullis及其团队)成功将质粒DNA封装在双层脂质囊泡内形成了稳定的质粒脂质颗粒(SPLP),这些颗粒通常包含辅助磷脂DOPE、PEG-脂质以及低水平(5-10 mol%)的阳离子脂质。
2001年,为了将核酸物质高效的封装在脂质囊泡内,Inex构建了含4种组分的新的脂质囊泡,在乙醇存在下,一定配比的寡核苷酸与阳离子脂质DODAP(1,2-dioleoyl-3-dimethylammonium propane)、PEG-脂质、胆固醇和磷脂混合,可将包封效率提高到70%。可见,含阳离子脂质、PEG-脂质、胆固醇和磷脂的4种组分的脂质颗粒,在20年前就已经公开。
此后,Protiva Biotherapeutics(后与Tekmira合并成为现在的Arbutus)的科学家也开发了含上述4种特定脂质组成的稳定的核酸-脂质颗粒(SNALP),虽然这些脂质组分类别都是Inex在实验中用过的,但Arbutus团队的脂质纳米颗粒有一个致密的核心(dense core),这与Inex开发的脂质囊泡存在区别。
Arbutus开发的具有致密核心的脂质颗粒SNALP,是目前我们广泛使用的LNP递送技术。针对该递送技术,Arbutus筛选出了4种脂类的脂质配比范围,并布局了相应的专利。
LNP组合物的专利布局
早期的LNP组合物,为了提高脂质递送系统的稳定性,非阳离子脂质部分偏向于采用较大的配比,而阳离子脂质通常不超过总脂质配比的30 mol%,相应实例出现在专利家族PCT/CA2002/000669、PCT/CA2002/000668等。
随后,Arbutus发现增加阳离子脂质的量将改善核酸-脂质颗粒的治疗活性,据此,在2009年递交了专利家族PCT/CA2009/000496(简称‘496家族),保护不限定脂质组分结构的宽泛的LNP组合物组分配比,同时,该家族也是LNP递送技术专利纠纷的主角。
针对家族成员US8058069B2和US9364435B2,Moderna曾向美国专利商标局的专利审判和上诉委员会(PTAB)提出专利的无效挑战,PTAB最终判决US8058069B2全部有效,US9364435B2部分有效。该判决对Arbutus在LNP领域的领导地位没有丝毫动摇,因为核心专利US8058069B2已足以保护LNP的知识产权。
该家族中国授权专利为CN102119217B,其授权权利要求涉及核酸-脂质颗粒,具体如下:
“一种核酸-脂质颗粒,包含:(a)核酸;(b)阳离子脂质,其占所述颗粒中存在的总脂质的50mol%-65mol%;(c)非-阳离子脂质,其包括磷脂和胆固醇或其衍生物的混合物,其中所述磷脂占所述颗粒中存在的总脂质的3mol%-15mol%,和所述胆固醇或其衍生物占所述颗粒中存在的总脂质的30mol%-40mol%;和(d)抑制颗粒聚集的缀合脂质,其占所述颗粒中存在的总脂质的0.5 mol%-2mol%。”
可见,在2029年之前,若想使用LNP递送系统,企业首先需要规避‘496家族的潜在风险。
2010年,Arbutus递交了同样涉及不限定脂质组分结构仅限定LNP组分配比的宽泛的专利家族。该家族区别于上述‘496家族,认为降低PEG链长度且增加PEG缀合脂质的摩尔百分比后,可提升包封效率和肿瘤靶向特性,其原因可能是PEG缀合脂质在以较高浓度存在时更均匀地分布在颗粒表面上。
除了典型的4组分LNP组合物外,当下也有部分研发团队,正在探索在脂质纳米颗粒中添加一种或多种其他组分,以拓展递送的目标组织类型或增加核酸药物的递送效率。
2020年,德克萨斯大学西南医学中心 Daniel Siegwart 教授实验室,开发了一种通过在脂质纳米颗粒中添加第五种成分——SORT脂质(Selective organ targeting nanoparticles),可以改变LNP在体内的器官靶向特异性,并实现 mRNA 对肝脏以外器官的靶向递送。
当下,国内外有多个研发团队正在致力于研究4组分或更多组分的LNP递送系统,以提高在人体肝外组织中的递送效率,此处我们并未逐一列出。
LNP组合物专利保护特点
LNP组合物部分的专利类型相对集中,主要为LNP组合物的组分以及组分配比。从上面的介绍中可以知道,包含阳离子脂质、胆固醇、磷脂和PEG-脂质的LNP组合物的组分,早在2001就已经报道,而现阶段在临床上广泛使用的LNP组分配比是Arbutus在2009年开发而成的,可见,目前对于LNP组合物部分的风险主要来自各组分的配比上,相应风险专利也主要集中在Arbutus手里。
整个LNP递送系统,除了LNP组合物部分存在宽泛的基础专利尚未到期外,在阳离子脂质结构部分也存在大量的专利布局。LNP组合物的风险前面已经说到,主要集中在LNP组合物配比上,而阳离子脂质体部分,根据其结构特异性,需考虑来自技术平台、特定结构以及结构的衍生应用等多方面的风险。因此,针对LNP递送系统,准备或已经进入LNP领域的企业建议针对性的进行风险排查,提前为后续的项目融资和产品上市做准备。
除了LNP递送系统外,还有一种成分相对简单的非病毒载体递送系统——GalNAc递送系统,下篇我们将继续分享GalNAc递送系统的技术发展以及专利保护情况。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
