成功进入十亿美元俱乐部
Cimzia® (活性成分:Certolizumab pegol)是由靶向TNFα的人源化抗体Fab片段与聚乙二醇 (PEG)缀合而成的,能够以剂量依赖的方式中和可溶形式和跨膜形式的人TNFα。
Cimzia®于2008年首次获得FDA批准,用于治疗克罗恩氏病 (Crohn’s disease),之后又相继获批用于治疗类风湿性关节炎 (RA)、银屑病关节炎(PsA)和强直性脊柱炎(AS)。剂型为皮下注射剂型。
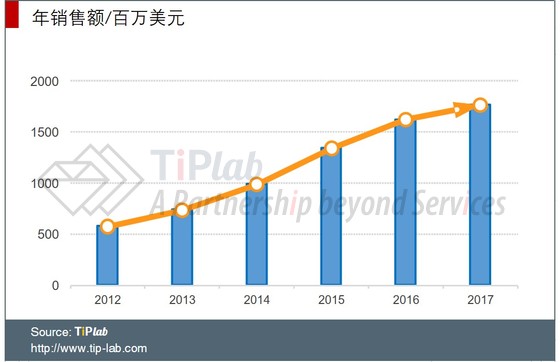
近五年来,Cimzia®的销售额一路持续增长,2014年成功进入重磅药俱乐部。2017年,Cimzia®的全球销售额已达到17亿美元。伴随着适应症及适用人群的拓展,预计其销量仍会继续增长。
缺少Fc区的TNF拮抗剂—Cimzia
Cimzia®最初是由Celltech公司开发的,2004年,Celltech被UCB以27亿美元收购,当时已经处于临床三期的CDP870 (即后来的Cimzia®)正是此次收购的重要资产,此次收购也帮助UCB进入了免疫疾病的治疗领域。
Certolizumab pegol是一种经PEG修饰的不含Fc区的抗体。抗体Fab区是由鼠互补决定区 (CDR)和人框架区 (FR)构成,并将人FR区中的一些氨基酸残基回复突变为鼠FR区的氨基酸残基,以提高对抗原的亲和力。
专利许可降低侵权风险
在之前的文章中,我们讲到过PDL拥有保护人源化抗体相关的Queen专利,多数重磅人源化抗体都落入了Queen专利的势力范围内,certolizumab pegol当然也未能幸免。最终,UCB与PDL签订了和解协议,以UCB向PDL支付1000万美元的专利许可费而结束了旷日持久的专利战。
Certolizumab pegol的Fab片段是在大肠杆菌中生产的,而该技术的使用权是从XOMA经专利许可获得的。2005年,UCB与Lonza签订了长期的供应协议由Lonza为UCB生产PEG修饰的抗体片段。
缺少Fc区有何优势?
与其他TNF大分子拮抗剂相比,certolizumab pegol的特别之处在于**缺少Fc区:
这意味着其ADCC效应和CDC效应最小**,而ADCC效应和CDC效应与传统抗TNF治疗带来的副作用密切相关。体外研究显示,adalimumab、infliximab和etanercept均可以引发ADCC和CDC效应,而certolizumab pegol则不会引发这些效应。
缺少Fc区还可以减少certolizumab pegol穿过胎盘而导致对胎儿造成的不利影响,这为certolizumab pegol在孕妇中的治疗应用奠定了基础。PEG的作用是增加药物的循环半衰期,这在一定程度上弥补了缺乏Fc区对稳定性和半衰期带来的影响。
可见,在certolizumab pegol的整个前期研发和生产过程中,UCB通过获取外部的专利许可或合作来尽快推进药物研发进度,并规避可能的专利侵权风险 。
除此之外,UCB自己也针对certolizumab pegol进行了积极的专利布局。下面就让我们一起来看一看。
保护certolizumab pegol的专利
活性成分专利
Celltech/UCB递交了一系列保护活性成分的专利,多层次地对活性成分进行保护。
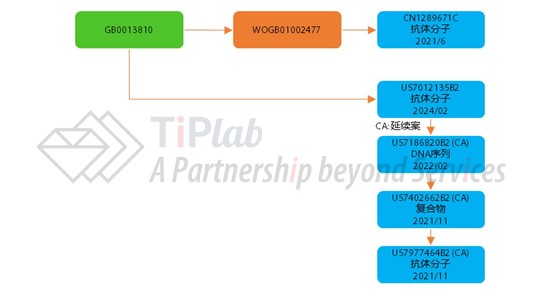
核心专利:US7012135B2
2001年,Celltech首先递交了保护certolizumab pegol的核心专利申请并获得了授权 (US7012135B2),权利要求1保护:

US7012135B2的权利要求1保护一种结合人TNFα的抗体分子,并限定了抗体的重链和轻链可变区序列,通过序列比对可知,权利要求中保护的序列与certolizumab pegol的可变区序列一致,US7012135B2的保护期至2024年2月。
延续申请:US7186820B2
接着,UCB递交了US7012135B2的延续申请并获得了授权 (US7186820B2),US7186820B2的权利要求1保护:

US7186820B2保护编码抗体重链的DNA序列,其中该抗体分子可以与TNFα特异性结合,只限定了重链的三个CDR区的序列。这些序列涵盖了Certolizumab pegol的重链可变区的CDR序列,US7186820B2的保护期至2022年2月。
延续申请:US7402662B2及US7977464B2
除了对抗体及编码抗体的序列进行了保护,UCB还获得了保护与PEG缀合的抗体专利US7402662B2 (US7186820B2的延续申请),权利要求1保护:

US7402662B2的权利要求1保护一种复合物,包含经修饰的Fab片段和通过与Fab重链的半胱氨酸残基连接的lysyl-maleimide基团共价连接的甲氧基聚乙二醇残基。权利要求限定了Fab片段的重链和轻链序列以及聚乙二醇重复单元的数量。复合物的结构组成涵盖Certolizumab pegol,US7402662B2的保护期至2021年11月。
这个家族中还包含一个延续专利US7977464B2,保护一种结合人TNFα的抗体分子,不过同时限定了抗体重链和轻链的三个CDR序列,根据专利权终止声明 (Terminal Disclaimer),US7977464B2保护期也是至2021年11月。
中国同族:CN1289671C
同族的中国专利CN1289671C保护一种结合人TNFα的抗体分子,并限定了抗体重链和轻链的部分CDR序列,保护期至2021年6月。
方法专利
此外,UCB还获得了保护一种将效应分子连接至蛋白质的方法专利 (US8378073B2)。该方法包括两步:第一步:使用渗滤缓冲液活化蛋白质的一个或多个半胱氨酸残基;第二步:将处理后的蛋白质与效应分子反应。US8378073B2的保护期至2029年12月。

与之同族的中国专利也获得了授权 (CN101212984B2),保护一种将一个或多个PEG分子连接至抗体Fab片段上的半胱氨酸的方法。保护期至2026年6月。
拓展目标人群和产品适应症
2017年底,欧洲药品管理局 (EMA)批准Cimzia®的标签变更,Cimzia®成为第一个可用于治疗妊娠期和哺乳期女性慢性风湿性疾病的抗TNF治疗剂,这得益于缺少Fc区的Cimzia®很少会通过胎盘和母乳转移至胎儿或婴儿。2018年3月,FDA也批准了Cimzia®的这一标签变更。
适应症拓展方面,Cimzia®用于银屑病的治疗在美国和欧洲已完成临床试验并递交了上市请求,有望于2018年中获批。2017年3月,FDA发布了Cimzia®用于治疗多关节幼年特发性关节炎 (pJIA)的完整回复函,其中对药代动力学数据的可靠性表示担忧,UCB也正努力解决这一问题。
如何快速进入一个新的治疗领域
2004年以前,UCB在免疫疾病治疗领域的积累并不多,自从收购Celltech之后,UCB不仅成功将Cimzia®推向了重磅药行列,还结合产品优势,不断拓展新的适应症和治疗群体。
当进入一个新的治疗领域时,推出一个新产品更容易面临专利侵权的风险:
UCB未雨绸缪,通过专利许可或诉讼及早规避/化解了这些风险,并结合主动的专利布局为其产品日后的市场地位保驾护航,从而进一步巩固了自己的竞争优势。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
