靶向MASP-2的抗体药
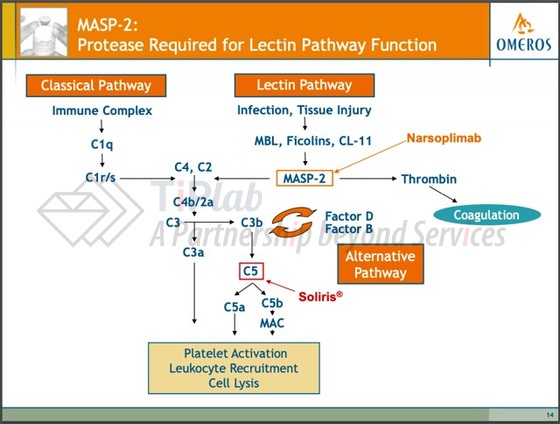
Narsoplimab(OMS721)是一款由Omeros Corporation开发的全人IgG4单克隆抗体,靶向补体凝集素途径中的效应酶—甘露聚糖结合凝集素相关的丝氨酸蛋白酶2(MASP-2)。与其他补体抑制剂不同,narsoplimab对MASP-2抑制作用并不会干扰抗体依赖的经典补体激活通路,这是获得性免疫应答的一个关键组成部分。2021年1月19日,FDA授予了narsoplimab生物制剂上市申请优先审查资格,用于治疗HSCT-TMA。如果获批,narsoplimab将成为首款用于治疗HSCT-TMA的抗体药。
HSCT-TMA是造血干细胞移植(HSCT)的一个重要且致命的并发症,主要是由HSCT引起内皮细胞损伤导致,而内皮细胞损伤介导的凝集素补体通路的激活,在HSCT-TMA的发展中起重要作用。
Narsoplimab活性成分专利家族
Narsoplimab活性成分家族在中美欧的保护范围不同,US和CN更宽泛些,涉及多种变体,而EP则限定了特定的重链和轻链可变区,这对于竞争者的阻挡力度也不尽相同。下面我们围绕活性成分专利家族展开讨论。
2012年5月4日,OMEROS以美国临时申请US61/482,567为优先权,提交了涉及narsoplimab活性成分的专利申请PCT/US2012/036509。该PCT申请进入EP的授权公告号为EP2704743B1,权利要求1要求保护一种分离的人单克隆抗体或抗原结合片段,功能上限定结合MASP-2并且抑制MASP-2依赖性补体激活,结构上限定重链和轻链可变区序列包含SEQ ID NO: 20和24,即为narsoplimab重链和轻链可变区,为生物类似药开发者提供了障碍。

进入CN的专利申请授权公告号为CN103687620B,权利要求1要求保护涉及多组不同CDR序列的人抗MASP-2单克隆抗体或其抗原结合片段,其中narsoplimab重链CDR序列为SEQ ID NO: 28、32和37,轻链CDR序列为SEQ ID NO: 42、47和51。
同时独立权利要求6和独立权利要求8从重链和轻链可变区序列角度保护了narsoplimab和其多个变体,其中独立权利要求6涉及多个重链、轻链可变区序列组合,而独立权利要求8则涵盖了包含SEQ ID NO: 20和24及其变体的抗MASP-2抗体,并限定部分氨基酸残基位点的序列。该专利保护了narsoplimab及其多个变体,尤其是独立权利要求8,只要满足相应位点氨基酸残基的重链和轻链可变区的任意变体,都能落进其范围。

该PCT申请未进入US,OMEROS采取了另外一种专利布局策略在US保护narsoplimab及其变体活性成分,要求与上述PCT申请相同的优先权,递交了专利申请US13/464334,授权公告号为US9011860B2。和CN103687620B独立权利要求1类似,权利要求1涉及多组靶向人MASP-2的全人源单克隆抗体序列,但不同的是该申请中重链CDR3和轻链CDR1、CDR2采用序列通式的方式进行保护,保护范围更宽泛,涵盖了narsoplimab在内的多个抗MASP-2抗体。

以US13/464334为母案,OMEROS陆续递交了多个分案或延续案,加强narsoplimab及其多个变体的活性成分专利保护。其中US9475885B2和US10683367B2分别利用序列组合、通式、同源性限定等方式,保护了涉及多组不同CDR序列或重轻链可变区序列的narsoplimab变体。
由此可见,该活性成分专利家族不仅旨在保护narsoplimab,同时通过不同CDR序列和重轻链可变区序列组合、通式、同源性限定等方式保护了大量的narsoplimab变体,这给竞争者想通过设计narsoplimab变体来规避风险造成了较大的障碍。
Narsoplimab医药用途专利家族
2014年10月,OMEROS分别以US61/892283和US62/020845为优先权,递交了医药用途专利申请PCT/US2014/061236和US14/517,750。PCT进入CN的原始申请文件权利要求1请求保护一种宽泛的医药用途:利用MASP-2抑制剂去抑制TMA患者MASP-2依赖性补体激活,并限定TMA类型,包括移植继发性TMA。

审查员指出OMEROS先前递交的专利申请US20130266560A1,实施例公开了MASP-2抑制剂,可以用于治疗患有或有风险患TMA的受试者。本申请和该对比文件的区别技术特征仅为限定TMA的类型,这对本领域的技术人员是显而易见的,因此不具备创造性。
OMEROS因此进一步增加限定,授权专利CN105683219B的权利要求1限定MASP-2抑制剂为抗MASP-2抗体,患者为接受同种异体HSCT-TMA,并限定抗体结合表位以及重轻链可变区序列SEQ ID NO: 67和70,即涵盖narsoplimab,获得了一个特定抗体治疗特定疾病的范围。

PCT申请进入EP后的授权专利EP3057993B1也获得了一个类似的较窄保护范围。而同族US14/517,750专利申请在限定到抗体具体CDR序列后,审查员认为尽管申请人争辩不同TMA症状以及治疗方法不同,但根据现有技术的披露,本申请权利要求1要求保护的技术特征(特定结构的抗体、造血干细胞移植后TMA适应症)的组合对于本领域技术人员是显而易见的,并且申请人也未证明预料不到的技术效果,因此仍不能克服创造性问题,最终放弃了,申请人后续应该会递交分案。

从narsoplimab看专利布局策略
OMEROS递交的活性成分专利家族,不仅保护了narsoplimab,还采用多种方式保护了多个narsoplimab变体。在活性成分专利布局策略中,除保护目标产品外可以采用序列通式、同源性限定等方式保护临床效果较好的分子,扩大专利保护范围,为竞争者的规避设计设置较大的专利壁垒。
此外,想要获得宽泛的治疗机理的医药用途权利,一方面,申请人可以掌握专利申请的递交时机,较早递交专利申请,并在专利文本撰写上极可能满足获得宽泛范围的要求;另一方面,在存在现有技术较多的情况下,也尽可能发掘可以证明预料不到效果的发明点,以获得一个较为稳定的范围。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
