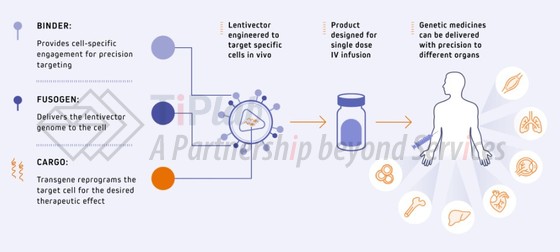
Interius的平台能够直接在患者体内生成 CAR-T 细胞,并可能通过将 DNA 插入患者基因组来提供更持久的治疗效果。不同于传统 CAR-T 疗法需要细胞采集、工程改造和回输,Interius旨在通过单次静脉输注给药,无需化疗预处理和复杂的细胞处理。
Interius 由宾夕法尼亚大学科学家 Saar Gill 博士和生物技术专家 Bruce Peacock 共同创立,最初专注于利用其创新的基因递送平台直接在体内生成 CAR T 细胞,用于治疗血液系统恶性肿瘤。
Interius的平台涉及一种基于 VSV-G 假型载体的工程化慢病毒载体,包括去靶向病毒融合部分 (Gen 2.1 Fusogen) 和膜结合靶向部分(Binder),能够在体内转导目标细胞类型,而无需进行淋巴细胞清除。
野生型VSV-G 假型载体由于其广泛的趋向性而无法用于体内疗法。VSV-G 的受体结合和融合是两个独立的功能,因此,可以通过去靶向病毒融合部分降低 VSV-G 对其天然受体(低密度脂蛋白受体LDL-R)的亲和力,同时利用膜结合靶向部分将其重定向至目标细胞来重新定义 VSV-G 假型载体的趋向性。
Gen 2.1 Fusogen主要引入氨基酸突变降低天然受体靶向性和增强稳定性:
降低天然受体靶向性:在 VSV-G中引入单点突变(例如 K47Q)使 VSV-G 无法与LDL-R结合,而不会破坏其融合潜力。为了识别这些突变,通过对野生型VSV-G 与 LDL-R 结合的晶体结构进行计算机模拟分析寻找靠近 LDL-R 上带电残基的 VSV-G 残基,在这些残基上引入相反电荷可以破坏 VSV-G 与LDL-R之间的相互作用。
增强血清和热稳定性:引入了增强血清和热稳定性的氨基酸取代,避免其被人血清灭活,比如:I182E、T214N 和 T352A 替换。
Binder部分进行优化以降低 Fc 受体介导的转导风险:
Binder 的第一代设计为 抗 CD7 scFv,其在载体表面由IgG1 Fc的“茎” 支撑,并通过人源 CD28 跨膜结构域锚定于载体包膜上,其后连接HIV-1 gp41 的包膜掺入基序。为了降低 Fc 受体介导的转导风险,对优化版本的 Binder 茎部进行了多个突变。
Gen 2.1 Fusogen 可以与靶向各种表面抗原的Binder一起进行假型化,比如:靶向 CD7、CD4 或 CD8 的 scFv。
Saar Gill 博士为发明人的专利家族PCT/US2021/021904(2021年递交,申请人:UPenn)涉及工程化病毒颗粒的基础专利,有三个US成员已获得授权,其中一个授权专利US11191784B2限定病毒颗粒包含工程化包膜(对应Fusogen)、用于结合靶细胞的异源多肽靶向部分(对应Binder)和编码目的异源多肽的核酸分子(对应CAR)。
Interius还有一系列围绕病毒载体的专利家族,涉及Binder结构设计(PCT/US2023/070897)、scFv(PCT/US2022/081616)、Fusogen突变体(PCT/US2022/081616、PCT/US2023/062378)等。
