U3-1402临床试验结果积极
在过去几年中,TKI疗法(tyrosine kinase inhibitor)如osimertinib等显著地提高了晚期或转移性NSCLC的治疗效果。但对携带EGFR突变的NSCLC患者而言,在接受TKI治疗后,往往一年内会对TKI产生抗性,此时这些患者的治疗选择非常受限。
U3-1402的初步临床试验结果
在2019年ACSO大会上,Daiichi Sankyo公布了U3-1402的全球1期临床试验(NCT03260491)数据,结果显示接受U3-1402治疗的16名携带EGFR突变且对TKI疗法具有抗性的NSCLC患者,所有患者的肿瘤体积都有所缩小,表明U3-1402具有良好的抗癌活性和安全性。
涉及U3-1402治疗用途的专利保护
针对U3-1402的治疗用途,2018年2月,Daiichi Sankyo递交了国际申请PCT/JP2018/007152(公开号:WO2018159582A1),其权利要求19涉及一种使用抗HER3抗体-药物偶联物治疗EGFR-TKI抗性NSCLC的方法。
PCT/JP2018/007152尚未进入其它国家或地区。
新型抗体偶联药物U3-1402
U3-1402是Daiichi Sankyo在研的新型抗体偶联药物,由靶向HER3的单抗patritumab与依喜替康(exatecan)通过马来酰亚胺-GGFG接头(maleimide-GGFG peptide linker)连接而成,每个抗体连接有8个exatecan。
依喜替康为拓扑异构酶Ⅰ抑制剂(topoisomerase I inhibitor),属于DX-8951(DXd)的衍生物。
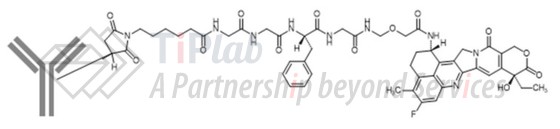
U3-1402的靶向部分
当U3-1402与癌细胞上异常表达的HER3结合后,其被内吞进入体内并被溶酶体内组织蛋白酶切割释放出exatecan,发挥抑制拓扑异构酶Ⅰ的活性,诱导癌细胞的死亡。
HER3靶向抗体patritumab
HER3属于HER受体酪氨酸激酶家族的成员之一,其在多种类型的癌症中均有表达;而且HER3过表达与NSCLC癌细胞的转移及患者存活率降低有关,但目前尚未有任何HER3靶向剂获批。
Patritumab为U3 pharma与Amgen共同开发的靶向HER3的单抗,2008年Daiichi Sankyo收购U3 pharma获得其在研的patritumab及其相关的知识产权。
2016年,因patritumab的临床试验显示其与对照组无明显区别,Daiichi Sankyo终止了patritumab在治疗NSCLC中的研发。但Daiichi Sankyo的研究人员另辟蹊径将其应用于ADC药物的开发,U3-1402因此产生。
保护patritumab活性成分的专利申请
在patritumab的研发进程中,U3 pharma递交了多项专利申请对其进行保护。
2006-12-29,U3 pharma递交了涉及抗HER3抗体的国际申请PCT/EP2006/012632,该申请进入了CN、EP等国家和地区。
PCT/EP2006/012632在中国的授权专利CN102633881B的权利要求1保护一结合于HER-3的分离的抗体,限定了抗体重链和轻链的CDR序列,通过序列比对可知,其保护范围涵盖patritumab。
随后,2007年1月,U3 pharma递交了美国专利申请,目前已经获得专利权—US7705130B2,其保护一种结合HER-3的结合蛋白,限定了抗体重链和轻链的序列。
在US7705130B2的基础上,U3 pharma又递交了一系列的分案申请,如分案US8771695B2涉及使用HER3结合蛋白治疗表达HER3的癌症;分案US10100124B2保护编码HER3结合蛋白的核酸分子,限定了核酸分子编码的重链和轻链的氨基酸序列。
U3-1402 的连接部分
U3-1402的连接部分为maleimide-GGFG linker,patritumab通过maleimide-GGFG linker与依喜替康连接,具有较好的安全性和稳定性。
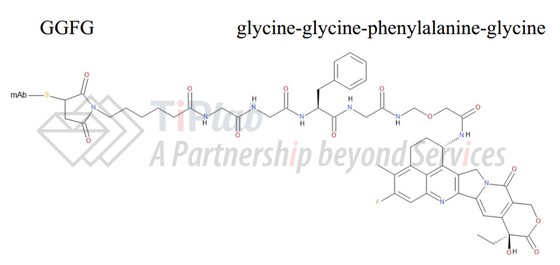
U3-1402的GGFG peptide linker
GGFG peptide linker属于cleavable linker的一种,后者还包括hydrazone(腙),disulfide(二硫化物)及peptide linker(多肽)。
Hydrazone linker通过酸水解而释放药物;disulfide linker在体内循环中比较稳定,其通过与谷胱甘肽相互作用而被裂解;peptide linker较前两种更稳定,其在细胞内酶如蛋白酶的裂解作用下释放药物,能够更好地控制药物的释放。
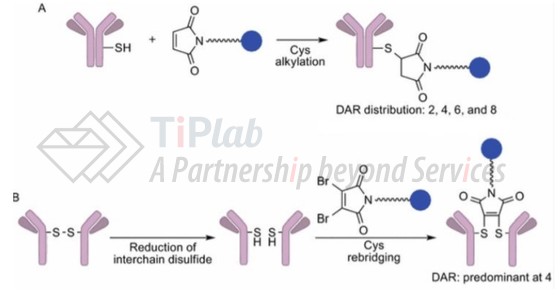
U3-1402的半胱氨酸缀合方式(cysteine conjugation)
Cysteine conjugation发生于抗体的链间二硫键与药物半胱氨酸的巯基(sulfhydryl group of cysteine)之间,对IgG1型抗体,其四个链间二硫键可被还原,形成8个缀合位点,因此该方法得到的药物与抗体的比例一般不超过8。
对U3-1402,其patritumab抗体二硫键与依喜替康的马来酰亚胺的半胱氨酸残基(cysteine)缀合,每个抗体连接8个依喜替康,药物与抗体的比例为8。
涉及U3-1402连接部分的专利保护
为了更好地保护U3-1402的连接结构,2015年Daiichi Sankyo递交了涉及抗HER3抗体药物偶联物的国际申请PCT/JP2015/002020,该申请进入了CN、EP等国家和地区。
PCT/JP2015/002020对应的中国专利申请CN106163559A,涉及一种抗HER3抗体-药物偶联物的结构通式。
PCT/JP2015/002020的延续案申请US20170021031A1,其权利要求1为:
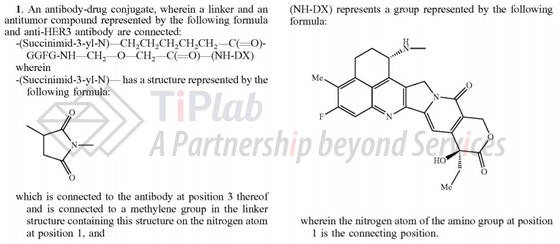
US20170021031A1的权利要求1请求保护一种抗HER3抗体-药物偶联物,限定了linker和drug的结构通式,并限定了抗体与linker连接的位置,其请求保护的范围涵盖U3-1402。
结语
ADC药物是由单抗与化学药物偶联而成,其兼具化药的强大杀伤力与单抗的高度靶向性并具能降低副作用,在肿瘤治疗领域具有较好的发展前景。
目前有超过60种ADC药物处于不同的临床阶段,其组成的抗体针对的靶点决定了这些ADC的适应症。
通常来说,ADC需要选择生物学机制明确且存在未满足的临床需求的靶点;对抗体,药物、linker及各组分连接方式的改进也显著地促进了ADC药物的发展。相应地,在药物的研发进程中,对相关的技术创新提供专利保护为后续药物的市场提供了重要的保障。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
