IL-23抑制剂risankizumab
IL-23信号通路
白细胞介素-23(interleukin-23,IL-23)是一种天然存在的异源二聚体细胞因子,属于IL-12分子家族的成员,由特异性的IL23p19亚单位(IL-23A)和与IL12相同的IL12p40亚单位通过二硫键组成。
研究发现IL-23能够作用Th17细胞亚群诱导其产生IL-17,并可诱导Th1型细胞分化及产生促炎性细胞因子IFN-γ。因此IL-23/IL-17信号通路在慢性炎症形成过程中发挥着关键作用,其异常是导致自身免疫性疾病发生的重要机制。
基于对IL-23/IL-17信号通路的研究,研究人员开发了以IL23为靶点来治疗自身免疫性疾病的新疗法。
Risankizumab
Risankizumab是靶向IL-23A的人源化IgG1单抗,其能选择性地与IL-23的p19亚基结合并抑制IL-23与其受体的相互作用,阻断IL-23/IL-17信号通路来调节自身免疫反应。
Risankizumab最初由Boehringer Ingelheim(BI)开发用于治疗银屑病,2016年4月,AbbVie与BI达成合作协议,从BI处获得尚处于临床3期的risankizumab。
目前risankizumab由AbbVie和BI联合开发,AbbVie负责在全球范围内领导开发和商业化SkyriziTM。根据合作协议,AbbVie也从BI处获得了risankizumab相关的知识产权。
涉及risankizumab活性成分的专利家族
针对risankizumab抗体,2011年11月2日,BI 同一天递交了涉及抗IL23抗体的国际申请PCT/US2011/058869和美国申请US13287208(授权公告号:US8778346B2)。
美国的授权专利US8778346B2的权利要求1为:

保护一种抗IL-23 p19的抗体或抗原结合片段,限定了抗体重链和轻链的CDR序列。经过序列比对,其保护范围涵盖risankizumab。US8778346B2预计2031年11月到期。
PCT/US2011/058869进入中国国家阶段的专利申请CN107522784A,请求保护一种人源化抗IL-23 p19抗体,限定了抗体重链和轻链的CDR序列,并限定了抗体对IL-23结合的KD值。
CN107522784A仍处于审查阶段,尚未获得授权。
Risankizumab的治疗用途
银屑病
2019年4月,FDA批准risankizumab用于治疗成人重度至重度斑块状银屑病,其使用方法是在第0、4周分别给药一次,之后每3个月(12周)用药一次,剂量为150mg,皮下注射。
银屑病又称牛皮癣,是一种多种免疫细胞共同参与的慢性炎症性皮肤病,由于表皮细胞过度增长形成导致瘙痒和疼痛的磷片和斑块。
与正常人的相比,银屑病患者皮肤中IL-23表达显著上调,IL-23激活Th17细胞,释放炎性因子引起银屑病的症状。使用risankizumab后,IL-23对Th17细胞激活的作用被抑制,阻断IL-17等炎性因子的产生,从而有效控制银屑病的症状。
risankizumab的临床试验表现
Risankizumab的获批是基于包括ultIMMa-1、ultIMMa-2等在内的全球3期临床试验,这些试验旨在评估与安慰剂和ustekinumab相比risankizumab在治疗成人中度至重度斑块状银屑病中的安全性和有效性。
Ustekinumab也是针对IL-23/IL-17信号通路的单抗,其靶向IL-12和IL-23的p40亚基,目前是临床上广泛认可的治疗中度至重度斑块状银屑病的药物。
ultIMMa-1和ultIMMa-2研究结果的结果显示,在治疗16周后,接受risankizumab治疗的患者达到PASI 90(银屑病面积和严重程度指数改善90%)的比例高达75%,有近一半的患者(47%)达到了PASI 100(完全清除),显著高于安慰剂组和对照组(接受ustekinumab治疗)。
这些结果表明,risankizumab对银屑病具有较好的治疗效果,更利于患者疾病的改善。
涉及治疗用途的专利申请
为了更好地保护risankizumab的治疗用途,BI布局了大量的专利申请。
US10202448B2
US8778346B2(保护抗IL-23A抗体)的分案US10202448B2涉及一种治疗与IL-23表达增加相关病症的方法,包括向受试者施用如US8778346B2权利要求1中限定的抗体。
除银屑病外,AbbVie还在进行相关的临床试验,评估risankizumab在治疗克罗恩病和哮喘等疾病中的潜力。
哮喘适应症
2015年6月,AbbVie和BI开展了评价risankizumab在治疗重度持续性哮喘中的疗效和安全性的临床试验(NCT02443298)。该临床试验目前已经完成。
2016年4月13日,BI同时递交了涉及使用抗IL-23A抗体治疗哮喘的的国际申请PCT/US2016/027263和美国申请US20160304602A1。
US20160304602A1的权利要求1涉及施用抗IL-23A抗体治疗重度持续性哮喘的方法,该专利申请目前处于放弃的状态。
PCT/US2016/027263对应的中国专利申请CN107530425A,其权利要求1为:
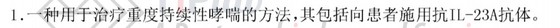
请求保护一种治疗重度持续性哮喘的方法,包括向患者施用抗IL-23A抗体。
CN107530425A权利要求1请求保护的范围相关比较宽泛,该专利目前处于审查阶段,尚未获得授权。
克罗恩病适应症
目前,AbbVie和BI有多项评估risankizumab治疗克罗恩病的临床试验在进行当中,如NCT03105102和NCT03105128等。
针对该适应症,2017年10月11日BI递交了国际申请PCT/US2017/056082和美国专利申请US20180105588A1。
US20180105588A1的权利要求1为:

涉及一种诱导克罗恩病缓解的方法,限定施用抗IL-23A抗体,并限定了施用抗体的剂量。
PCT/US2017/056082目前尚未进入中国国家阶段。
结语
在自身免疫性疾病领域,除SkyriziTM外,AbbVie曾推出过“重磅炸弹药物”修美乐(Humira®)。Humira®为靶向TNFα的单抗,在治疗斑块状银屑病和其它免疫性疾病中占据着重要的地位。
目前,Humira®的核心专利已经到期,其面临着其生物类似药的激烈竞争,这对Humira®的市场造成较大的冲击。随着银屑病新药SkyriziTM的上市,以及未来可能的拓展适应症的获批,将为AbbVie的市场增长提供新的动力。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
