1963年,加拿大的McCulloch和Till首次发现小鼠骨髓中的造血干细胞,能够重构整个造血系统。自此,这类具有多向分化潜能的细胞开始进入人们的视野。
随着技术发展至今,已经有多种不同的干细胞被分离、鉴定甚至制备出来。根据干细胞的发育阶段和来源,可以将干细胞分为胚胎干细胞(Embryonic stem cell,ESC)、成体干细胞(Adult stem cell,ASC)、诱导多能干细胞(Induced pluripotent stem cell,iPSC)等等。当下备受瞩目的当属诱导多能干细胞(iPSC),许多生物医药公司都进入该赛道开展相关布局,临床试验涵盖多种适应症,行业发展迅速。2013年,iPSC龙头企业Fate Therapeutics于美国纳斯达克上市,2019年,衍生自iPSC的现货型NK细胞管线FT516 IND获批,成为首个获得FDA批准用于临床研究的iPSC衍生工程化细胞疗法。
2006年,Shinya Yamanaka等人用逆转录病毒将重编程因子Oct4、Sox2、Klf4和c-Myc转入小鼠成纤维细胞,获得了具有胚胎干细胞特征的干细胞,随即开启了干细胞领域的新时代,Shinya Yamanaka也因此获得了2012年的诺贝尔生理学或医学奖。Yamanaka等人制备的干细胞被命名为诱导多潜能干细胞(iPSC),由体细胞到iPSC的制备过程被称为“重编程”。
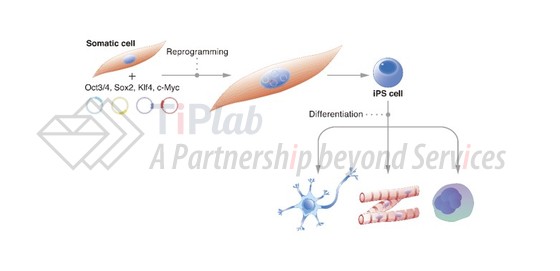
iPSC具备与胚胎干细胞类似的多潜能分化能力,这一属性使得在iPSC横空出世的几年内,很快被诱导分化成不同的细胞类型,尝试应用在不同疾病的治疗中,例如iPSC来源的心肌细胞治疗心脏衰竭、iPSC分化的多巴胺能神经元治疗帕金森病、基于iPSC衍生的NK细胞开发的CAR-NK细胞治疗肿瘤等。然而,治疗不同的疾病,所需要的细胞类型不同,因此自iPSC起始分化路径选择繁多,加之领域内玩家面临的情况不同,实难穷尽,故本系列文章将不重点讨论iPSC诱导分化的相关内容。
说回到重编程制备iPSC的过程,想象一下,Yamanaka等人设计的重编程步骤就类似于计算机系统的“归零重置”的程序,在已经完成分化的体细胞中引入四个重编程因子,编程为初始的干细胞状态。后来的研究表明,“归零重置”是通过抹除体细胞表观遗传特征,建立胚胎干细胞的选择性表观遗传标志,逆转细胞的分化时钟,重新赋予细胞多潜能性。通过该步骤获得的iPSC与胚胎干细胞相比,除避免了胚胎干细胞制备过程中可能引入的伦理道德问题外,还有可能解决移植的免疫排斥,及体外稳定扩增等问题。
作为干细胞领域备受瞩目的新星,自iPSC相关研究问世以来,越来越多的研究者加入iPSC的研究队伍,随之发展的近20年中,也有不少围绕iPSC的发明进行了专利保护,那么想要进入iPSC赛道,在技术优化及专利风险层面有什么需要特殊关注的吗?我们将在本系列文章中,与各位讨论分享TiPLab在“iPSC的重编程制备”研究中的一些感悟。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
