业界对放射性药物的热度一直持续。过去十年来,放射性药物相关的合作和并购交易总额约为 330 亿美元,多家布局肿瘤领域的 MNC 也持续加大对放射性药物的投入。
Aktis 认为放射性药物领域仍处于起步阶段,许多公司都专注于两个已被证实有效的靶点SSTR2和PSMA。
Aktis 通过开发下一代技术,扩大靶向放射性药物的适用肿瘤范围,从而安全地递送高剂量α发射放射性同位素,使更多癌症患者受益。
α粒子比β粒子能量更高,射程更短。α放射性同位素的细胞杀伤力是β放射性同位素的 1000 倍,但射程只有两到三个细胞长度。
目前有多家公司正在开发用于治疗癌症的靶向 α 放射性药物,首个也是唯一获批的基于α粒子的疗法是拜耳的 Xofigo(镭-223),于 2013 年获批用于治疗伴有症状性骨转移的前列腺癌。
Aktis 构建了一个专有的微型蛋白放射性偶联物平台,旨在利用微型蛋白选择性地将 α 粒子的肿瘤杀伤效应递送至靶向肿瘤。具有高肿瘤渗透性和长时间滞留性,同时能够快速从正常器官和组织中清除,从而最大限度地降低全身辐射暴露。目前该平台已衍生多个候选产品。
- 其中,微型蛋白已证明能够有效结合现有递送技术(例如基于肽的放射性偶联物)无法靶向的肿瘤靶点。Aktis 将优先开发长度为40至70个氨基酸的微型蛋白,能够分别与成像同位素或治疗性同位素偶联用于患者筛选和肿瘤治疗。
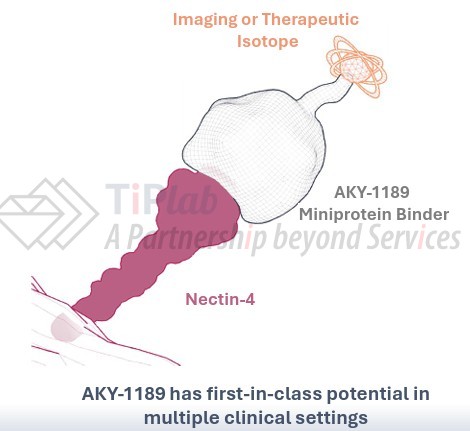
领先候选产品 [225 Ac]Ac-AKY-1189含有特异性结合 Nectin-4的微型蛋白 AKY-1189,并通过螯合作用与锕-225 (225 Ac) 偶联,用于治疗局部晚期或转移性尿路上皮癌(UC)以及其他多种表达 Nectin-4 的实体瘤。目前正处于临床 1b 期阶段,预计将于 2027 年第一季度获得剂量递增阶段的初步结果。Aktis 计划使用与 AKY-1189 偶联的成像用放射性同位素来筛选最有可能获益的患者。
225 Ac 是一种发射 α 射线的放射性同位素,当与 PSMA 结合肽偶联时,在化疗后转移性去势抵抗性前列腺癌的治疗中,其抗癌活性高于与相同结合肽偶联的 177Lu(发射 β 射线)。
Nectin-4 广泛表达于多种肿瘤表面,在正常组织中表达非常有限。Nectin-4 也是 ADC 药物 Padcev (辉瑞和安斯泰来开发)的靶点,其在 2024 年的全球销售额达到 19 亿美元,Padcev 的商业成功验证了 Nectin-4 作为尿路上皮癌治疗靶点的价值。
AKY-1189经过设计以最大限度地减少肾脏的重吸收,从而避免与经肾脏清除的放射性药物相关的潜在毒性问题。
第二个候选产品[ 225Ac ]Ac-AKY-2519,靶向表达 B7-H3 的实体瘤,例如前列腺癌、肺癌和乳腺癌,已进入人体临床成像阶段并计划于 2026 年上半年向 FDA 提交 IND 申请。 现有成像数据显示出良好的肿瘤摄取、较低的正常组织摄取以及差异化的生物分布特征,并从包括肾脏在内的正常器官和组织中快速清除的特性。
Aktis 已经与礼来建立了合作关系,并获得了多家大型制药公司的投资,其中包括默克、诺华和BMS。在递交 IPO 之前,该公司通过私募融资筹集了约 3.46 亿美元。
在专利方面,Aktis目前有多个关于候选产品或平台技术的专利家族,这些家族都于近几年递交且大部分处于审查阶段:
可能与AKY-1189相关:PCT/US2024/049013家族提供了靶向Nectin-4 的微蛋白、缀合物及其用途,其中一个US专利已获得授权,限定微型蛋白的氨基酸序列中的部分位点或全长序列。
可能与AKY-2519相关:PCT/US2024/059036主要涉及B7-H3 结合微蛋白的氨基酸序列;PCT/US2024/031449主要涉及B7-H3 结合微蛋白的缀合物。
可能与微型蛋白放射性偶联物平台相关:PCT/US2023/079693涉及微小蛋白的多种缀合物;PCT/US2025/025342涉及一种诱饵微蛋白,可以与靶向结合剂结合,以减少靶向结合剂在非肿瘤组织中的摄取和/或滞留。
没有与放射性有效载荷 225Ac 的专利或专利申请(现有技术难以保护)。
Aktis 还与明尼苏达大学、加拿大非营利组织 TRIUMF和蛋白质创新研究所(Institute for Protein Innovation)达成了专利许可。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
