LUXTURNA®—基因疗法新的里程碑
2017年12月,FDA批准LUXTURNA® (voretigene neparvovec-rzyl)用于治疗双等位基因RPE65 (Retinal pigment epithelial 65 kDa protein)突变相关的视网膜营养不良,一种由RPE65基因引起的遗传性视网膜疾病 (Inherited retinal disease,IRD)。
LUXTURNA®是FDA批准的首个用于治疗遗传性疾病的在体基因疗法 (In vivo),也是唯一一种治疗遗传性视网膜疾病的方法。
此前,FDA也批准了两款用于治疗癌症的CAR-T基因疗法。不同于LUXTURNA®,CAR-T是一种离体基因疗法 (Ex vivo):通过将患者的免疫细胞取出,对免疫细胞进行基因修饰后再回输至患者体内,并不是直接针对特定的致病基因突变。因此LUXTURNA®是真正意义的基因疗法,其获批预示着基因疗法新的里程碑。
作为FDA首个获批的治疗遗传性疾病的基因疗法,LUXTURNA®每只眼的治疗费用高达42,5000美元的价格,不过据报道,已经接受过该疗法的两位患者已经取得了不错的效果。年初,Spark制定了两项新的付款计划,以帮助符合条件的患者能够接受LUXTURNA®的治疗。
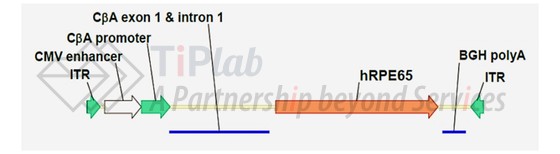
Voretigene neparvovec的结构
Voretigene neparvovec (AAV2-hRPE65v2)是一种重组腺相关病毒血清型2 (AAV2)基因治疗载体,具有巨细胞病毒 (CMV)增强子、鸡β肌动蛋白 (CβA)启动子和编码人RPE65蛋白的cDNA,其中,CβA启动子驱动RPE65基因的表达。
LUXTURNA®是通过使用重组DNA技术对天然存在的腺相关病毒修饰获得,在HEK293细胞中转染制造,在下游纯化过程中将空的AAV衣壳与完整的AAV衣壳分开,用于视网膜下注射。
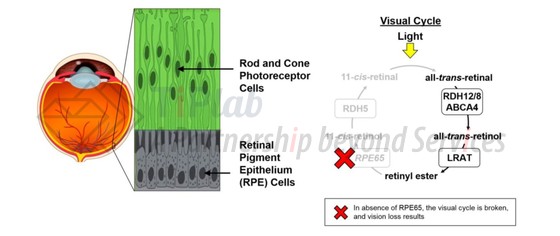
Voretigene neparvovec的作用机理
在正常的视觉循环中,RPE65基因表达RPE65酶,后者可以催化全反式视黄醇转化为11-顺式-视黄醇,从而通过光传导过程产生视觉。而在双等位基因RPE65突变的情况下,缺乏RPE65蛋白将导致视力丧失。Voretigene neparvovec可以将正常的RPE65基因递送至视网膜色素上皮 (RPE)细胞中,并表达功能性RPE65酶,从而恢复视觉循环。
基因治疗的发展史
在讲voretigene neparvovec的故事之前,我们先来回顾下基因治疗的发展史。
早在上世纪90年代,美国就开展了首例利用编码腺苷酸脱氨酶的逆转录病毒来治疗重症联合免疫缺陷病的临床试验,发现回输至病人体内的经过逆转录病毒修饰的白细胞能够正确合成腺苷酸脱氨酶,使得基因疗法的研究一度陷入狂热的程度。
不过,后来出现的两起不良事件给基因疗法的未来蒙上了一层阴影。其中一例是因为注射大量的腺病毒引起强烈的免疫排斥反应,导致多器官衰竭而死亡。而另一事件是逆转录病毒在基因组中的随机插入激活了原癌基因从而诱发白血病。
接连的两起不良事件打击了人们的信心,有些人甚至认为基因疗法是伪科学 (Pseudoscience),一些研究人员和投资者陆续放弃了这一领域,而一部分研究人员则重新回到基础研究中去,致力于探索更为安全的基因递送系统。
最终,人们发现非致病性的腺相关病毒 (AAV)可以克服其它病毒载体的缺点,被视为目前最有前途的基因治疗载体。一方面,AAV免疫原性较低,研究人员还剔除了野生型AAV中96%的基因组,进一步降低了致病风险;另一方面,AAV不会整合到宿主的基因组中,大大降低了致癌风险。此外,AAV具有多种血清型,对细胞感染的特异性较高。
AAV出现以后,基因疗法重现光明,基于AAV的临床试验也陆续开展起来。2012年,欧洲药品管理局EMA批准了第一款利用AAV治疗脂蛋白酯酶缺乏症的基因疗法Glybera®,由一家荷兰的公司UniQure开发而成。当然,voretigene neparvovec的诞生也有赖于AAV载体的出现。
围绕Voretigene neparvovec的专利保护
Voretigene neparvovec最初由费城儿童医院 (Children’s Hospital of Philadelphia,CHOP)和宾夕法尼亚大学 (UPenn)合作研发,CHOP在基因治疗技术方面拥有二十多年的研究基础。
2013年,Spark Therapeutics成立,主要对CHOP的基因治疗平台进行后期开发和商业化,专注于使用基因疗法治疗罕见遗传性疾病。
Spark获得CHOP的独占许可
早在20世纪90年代晚期,CHOP启动了使用AAV基因疗法治疗血友病的开创性临床研究。首先开展了通过肌肉注射AAV载体来治疗血友病B的临床试验,接着又利用AAV2靶向肝脏的特性开展了通过静脉注射来治疗血友病B的临床试验。为此,CHOP在同一天递交了一个US专利申请 (授权公告号:US6093392A)和PCT专利申请WO1998041240A1,US6093392A的权利要求1保护:
“A method of treating hemophilia in a mammal comprising: (a) providing a recombinant adeno-associated virus vector (rAAV), said rAAV comprising a nucleic acid encoding Factor IX operably linked to an expression control element; and (b) administering an amount of said rAAV to a mammal wherein said Factor IX is expressed at levels having a therapeutic effect on said mammal and wherein said therapeutic effect is an increase in coagulation of blood.”
这些早期的临床试验确认了AAV作为基因治疗载体的安全性。
而主导这些研究的Katherine A. High医生是CHOP细胞和分子治疗中心的主任,组建了一个多学科团队,致力于发现遗传疾病的新的基因和细胞疗法,并促进临床前发现向临床应用的快速转化。Katherine A. High也正是Spark的总裁兼首席科学官,她曾在FDA的细胞、组织和基因疗法咨询委员会任职五年,这段经历为其获得FDA首个批准的基因疗法提供了有利基础。

之后,CHOP一直致力于AAV载体相关技术的研究,包括:AAV载体的优化和纯化方法,并递交了一系列专利申请,比如:
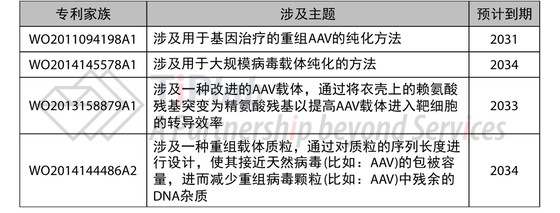
Spark通过独占许可的方式 (Exclusive license-in)从CHOP的获得了涉及修饰的AAV载体的专利家族,我们推测上述的专利家族都在其许可列表中。
Spark获得UPenn的独占许可
Jean Bennett是宾夕法尼亚大学 (UPenn)的眼科教授,也是Spark的联合创始人之一,负责voretigene neparvovec的临床试验。Jean Bennett和她的丈夫Albert Maguire (Penn眼科教授和CHOP医生)已经在先天性失明方面进行了超过25年的研究。

2001年,Bennett实验室与来自UPenn、弗罗里达大学和康奈尔大学的合作者一同证明了在RPE65突变的狗动物模型中使用AAV-RPE65可以改善RPE65缺乏导致的视觉损伤。
2002年起,宾夕法尼亚大学、弗罗里达大学和康奈尔大学为共同申请人以US60/283,766临时申请为优先权,递交了一系列涉及使用AAV治疗由RPE65基因引起的视网膜疾病的专利申请。
比如:美国授权专利US9433688B2保护使用携带RPE65的AAV病毒治疗Leber先天性黑朦的方法,权利要求1保护:
“A method for treating a human subject having Leber Congenital Amaurosis, the method comprising:
administering to said human subject by subretinal injection a recombinant adeno-associated virus (rAAV) vector comprising a nucleic acid sequence encoding a normal retinal pigment specific epithelial 65 (RPE65) gene operably linked to a chicken beta actin promoter/CMV enhancer, wherein said rAAV vector is administered in a dosage of from 1×109 to 2×1012 rAAV vector in a volume of at least 150 microliters, thereby restoring visual function in said human subject.”
US9433688B2保护的治疗方法包括通过视网膜下注射AAV载体,其包含编码与鸡β肌动蛋白启动子/CMV增强子连接的RPE65基因的核酸序列。
结合voretigene neparvovec的结构可知,US9433688B2的保护范围涵盖voretigene neparvovec的治疗用途,US9433688B2将于2022年到期,不考虑任何专利期延长和专利期调整。
Spark通过独占许可的方式获得了UPenn的一些专利权,其中包括US9433688B2。
通过对AAV载体的一些优化改进,2007年底,UPenn和CHOP合作开展了voretigene neparvovec的1/2期临床研究,共有12名患者,年龄从8岁到46岁不等,其中大多数患者在接受治疗后数周内都有视力改善。2015年的一项随机对照3期试验结果显示,与对照组相比,接受voretigene neparvovec治疗的患者在弱光下通过障碍测试的分数显著提高。
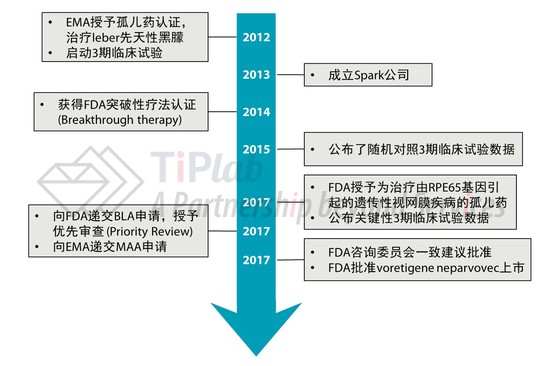
在临床试验阶段,voretigene neparvovec分别获得了FDA的突破性疗法和孤儿药认证。2017年7月,Spark向FDA递交BLA上市申请,通过优先审查 (Priority Review)途径提前于2017年12月就获得了FDA的批准。
2018年1月,Spark与诺华 (Novartis)签订了许可协议,由诺华取得了其在美国市场之外研发、注册及推广这一基因疗法的权限。
LUXTURNA®由Spark位于费城的制造工厂进行生产,这是美国第一家获得许可的用于制造遗传性疾病基因疗法的工厂。
Spark递交的AAV制造技术相关的专利申请
Spark自身也递交了部分AAV制造技术相关的专利申请,其中有四个重要的专利家族都将于2036~2037年间到期。
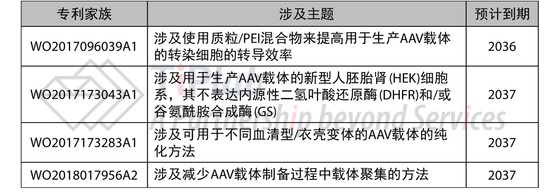
这些专利家族都涉及AAV的基础制备技术,若授权将会获得一个比较宽泛的范围,这些专利与许可获得的相关专利家族一同为竞争对手设置了障碍。
Spark利用其在制备平台方面的优势,开发了多种基因治疗产品管线,针对视网膜、肝脏和中枢神经系统。2014年,与Pfizer合作开发治疗血友病B的基因治疗产品SPK-9001,SPK-9001是一种可以表达凝血因子IX的AAV,并获得了FDA授予的突破性疗法和孤儿药认证。
Spark运用组合拳保护其知识产权
得益于初创团队在基因治疗方面的长期研究,2013年成立的Spark已经拥有了先进的基因治疗载体开发平台和一流的制备技术,不过Spark清楚的认识到,未来的商业成功部分取决于其对知识产权的运营能力。
在前期,Spark主要通过第三方许可的方式获得专利使用权,截止2018年2月,Spark已经拥有接近400件从外部许可的专利/专利申请;
而后期Spark通过持续不断的技术创新也递交了多件专利申请。这些专利/专利申请的保护主题大都涉及AAV或慢病毒载体、其制备方法、纯化方法、治疗用途以及其它与候选产品相关的技术。
此外,Spark还通过技术秘密 (know-how)的方式对其商业相关的重要技术进行保护。
可见,Spark综合运用许可、专利申请和技术秘密的方式维持其在基因治疗领域的地位,从而为其取得商业上的成功提供保障,而市场回报又可以为其不断推出受益罕见遗传病患者的基因治疗产品提供支持。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
