PTE的计算规则
随着制药研发支出的日益增加,为了鼓励新药开发同时降低药价的角度考虑,日本于1987年引入了专利期延长的制度,专利权的期限可以在提交期限延长注册申请后得到延长,但延长期限不超过5年。(参见:Art. 67 (2))
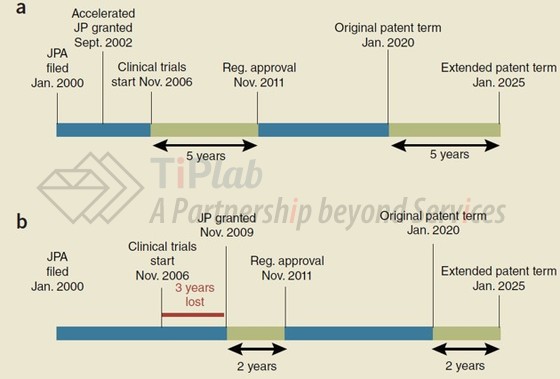
PTE期限从临床试验开始之日或专利授权之日(以较晚者为准)开始,并于上市批准邮寄给上市申请人的前一天结束,但最长不超过5年,上市后专利期剩余加上PTE之后可能会超过14年。
按照这个规则,如果专利的申请日相同,则在IND之前获得专利授权有利于增加PTE的期限,以下两个例子分别是在IND之前和之后获得专利授权对于PTE期限的影响。
可以发现,在图1a的情况中,专利授权在IND之前,按照PTE的计算规则,能够享有多达5年的PTE;而在图1b的情况中,专利授权在IND之后,则损失了长达3年的PTE。
PTE的适格条件
日本专利法及其相关规定并未规定仅“首次上市许可”才可以获得专利保护期延长。而且,基于现有规定,改良型制剂、新适应症等其它的后续上市许可也可以作为专利保护期限延长的基础,并可多次延长专利的保护期限,只要满足一定的条件即可(见下文讨论)。
日本最高院的两个重要判决影响了PTE的适格条件,分别是:2011年4月的PACIF®胶囊案和2015年11月的阿瓦斯汀®案。
PACIF®胶囊案
首次获批:2003年,活性成分为吗啡,用于镇痛,商品名为OPSO®,剂型为液体制剂。
胶囊剂获批:2005年,活性成分为吗啡,用于镇痛,商品名为PACIF®,剂型为新的缓释胶囊。
申请人递交了保护该胶囊缓释剂型专利的PTE申请,审查员否决了该PTE申请,之后申请人上诉至JPO上诉委员会,维持审查员的决定,因考虑到PACIF®与之前批准的OPSO®的活性成分和适应症完全相同。
IP高等法院则推翻了JPO上诉委员会的决定,批准该PTE申请,最后,最高院(第2009(Gyo-Hi)326号)也维持了高等法院的判决,认为:当“先前批准的产品不落入后续专利权利要求的范围内”,不应拒绝该PTE申请,换句话说,对于旧的活性成分的新剂型或给药方案等,都可能获得新的PTE。
2011年,针对该最高院的决定,JPO修订了审查指南,明确了PTE的适格条件:
a)对应获批药品应该包含递交PTE申请专利相关权利要求的所有技术特征;
b)先前批准相同活性成分和相同适应症的药品不能包含申请PTE延长专利最宽泛权利要求的所有技术特征
举个例子,如果首次批准化合物A的注射剂用来治疗X疾病,可获得活性成分专利的PTE,但不能获得片剂专利的PTE;而后续批准化合物A的片剂用来治疗X疾病,则活性成分专利不能再次获得PTE,但对应的片剂专利则可以获得PTE。
阿瓦斯汀®案
首次获批:活性成分为贝伐单抗,用于无法治愈或切除的进展性或复发性结直肠癌,给药方案为与其他抗癌药联用,5 mg/kg或10 mg/kg(体重),每两周或更长时间一次。
新给药方案获批:活性成分为贝伐单抗,用于无法治愈或切除的进展性或复发性结直肠癌,增加新的给药方案为与其他抗癌药联用,7.5 mg/kg(体重),每三周或更长时间一次。
Genentech递交了PTE申请,审查员驳回后,JPO上诉委员会根据现行审查指南再次驳回了PTE申请,基因泰克提出上诉,IP高等法院撤销了该决定,认为该PTE申请适格,JPO向最高法院提出上诉,最高法院维持了IP高等法院的决定(第2014(Gyo-Hi)356号)。
2016年,针对阿瓦斯汀最高法院的决定,JPO再次修订了审查指南,即PTE适格条件为:
1)对应获批药品应该包含递交PTE申请专利相关权利要求的所有技术特征;
2)先前批准的药物应当与之后批准的药物存在区别(包括活性成分、给药方案、剂量、适应症和用法存在区别)
也就是说,与先前批准相比,任何一种配制成分及其用量、给药方案、剂量、适应症和用法有所不同,均可递交新的PTE申请,也就是说会出现同一个专利对应不同药品获得多个PTE的情况,且同一个药品也会存在多个专利获得PTE。
针对上个例子来说,如果首次批准化合物A的注射剂用来治疗X疾病,可获得活性成分专利的PTE,但不能获得片剂专利的PTE;而后续批准化合物A的片剂用来治疗X疾病,则活性成分专利和片剂专利均可以获得PTE。
PTE的保护范围
根据Art. 68-2的规定,延长专利期限内的专利权保护范围根据延长专利期限所对应获批药品的内容确定:
“Where the duration of a patent right is extended (including the case where the duration is deemed to have been extended under Article 67-2(5)), such patent right shall not be effective against any act other than the working of the patented invention for the product which was the subject of the disposition designated by Cabinet Order under Article 67(2) which constituted the reason for the registration of extension (where the specific usage of the product is prescribed by the disposition, the product used for that usage)”
在PTE获批的通知书中,会说明针对药品的活性成分、用途、剂型或剂量等信息,也就是说,PTE延长的期限仅对于符合获批PTE中特征的药品才具有阻止作用。
需要注意的是,在考虑PTE时,需要将一个药品对应的所有PTE都考虑进去。

PTE对他人的阻止力度
简单来说,日本PTE的保护范围与获批产品的特征是对应关系,但我们需注意的是,针对同一个活性成分,可能会不断产生多个PTE,即,原研公司对于同一个活性成分后续新开发的适应症、给药方案或制剂等都可能分别递交PTE申请。因此,需要持续关注原研公司在药品生命周期的整个过程中新开发的特征及其对应的PTE。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
