理想的RNA递送系统
1978年,生物学家Paul Zamecnik和Mary Stephenson发现一段与劳斯肉瘤病毒35S RNA互补的十三聚体寡核苷酸可以抑制劳斯肉瘤病毒RNA的翻译。该发现揭示人为设计合成的RNA药物可成功抑制病毒基因的表达。
随后,经过20年的临床探索,1998年首个反义寡核苷酸(ASO)药物Fomivirsen获得FDA批准,用于治疗巨细胞病毒视网膜炎(CMV)。2004年首个核酸适配体(Aptamer)药物Pegaptanib获批用于治疗湿性老年黄斑病变患者的视力下降。接下来的十几年间都没有核酸药物获批上市,可见Fomivirsen和Pegaptanib的获批,并没有加速全球RNA药物的商业化,原因在于从给予RNA药物到递送至细胞内靶位点并发挥治疗作用的整个途径中面临多重障碍。
目前,临床开发的RNA药物主要形式包括ASO、小干扰RNA(siRNA)、微小RNA(miRNA)、信使RNA(mRNA)、RNA Aptamer等,这些RNA药物的形式差异决定了他们生化作用机制的不同,但基于其固有的结构特征,总是受到系统性和细胞性障碍的影响,阻碍其进入细胞内靶向区域,主要障碍在于:
RNA 容易被血液或体液中的核酸酶或水解酶破坏,并被肾脏快速清除;
其次,具有亲水性、带负电性和高分子量等理化性质的RNA难以穿过细胞膜进入细胞质;
在细胞内化后,内化的RNA经常通过早期/晚期的核内体和酸性溶酶体微环境转运,并被酶降解破坏,限制了RNA发挥作用。
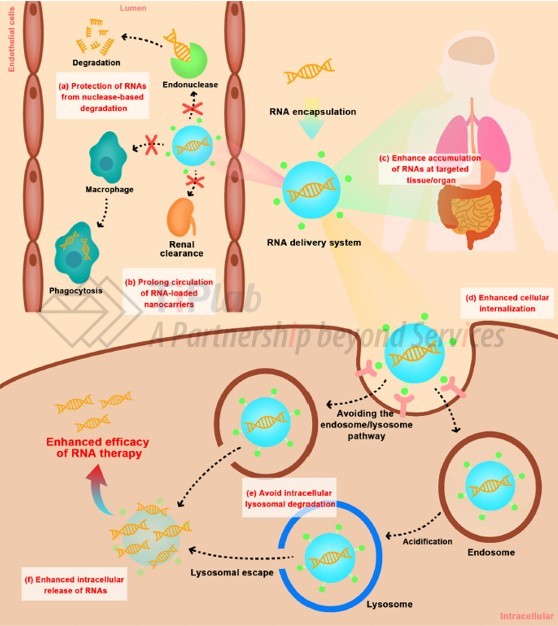
可见,理想的RNA递送系统应满足:在系统递送过程中对 RNA 进行有效的封装和保护,使其免受核酸酶降解;延长血液循环时间,防止肾脏快速清除和肝脏或脾脏的吞噬作用;增强靶向组织/器官的渗透和积累;促进靶向细胞内化;避免细胞内运输过程中的溶酶体降解;增强细胞质中RNA的释放以发挥作用。
为解决RNA递送问题,开发了基于病毒载体和非病毒载体的RNA递送系统,以保护RNA不被降解,最大限度地传递到目标细胞,并减少RNA药物暴露在非目标细胞。本系列,我们主要针对非病毒载体的RNA递送系统展开讨论。
非病毒递送载体
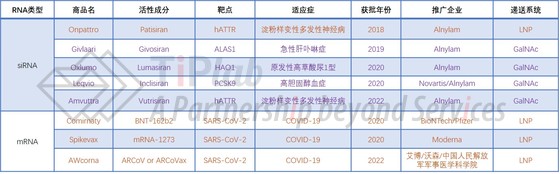
从2018年全球首款非病毒载体递送的siRNA产品获批上市,到现在已有8款(包含紧急使用授权)非病毒载体递送的RNA产品进入市场,涉及的递送系统有LNP(脂质纳米颗粒,Lipid Nanoparticle)递送技术和GalNAc(N-乙酰半乳糖胺,N-acetylgalactosamine)递送技术。
LNP递送技术
LNP递送系统是目前临床上成熟的RNA递送系统。已经上市的3款(包含紧急使用授权)mRNA新冠疫苗均采用了这类递送系统。
现阶段得到广泛应用的LNP组分主要包括4大类:阳离子脂质、胆固醇、PEG-脂质及辅助脂质。其中,阳离子脂质为LNP最关键的组分,可以通过静电吸附及自组装与核酸分子形成脂质-核酸复合物,保护核酸分子、促进内吞,并帮助核酸分子从溶酶体逃逸。
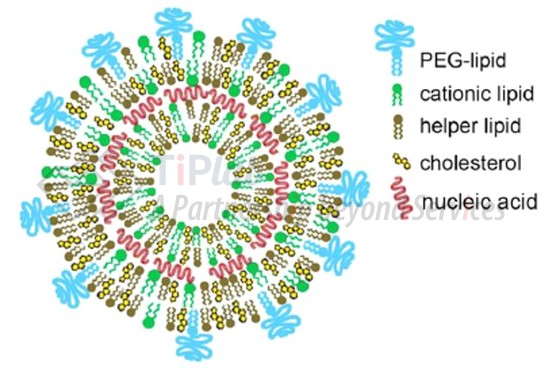
LNP领域占据重要地位的企业有Arbutus,其研究推动了LNP递送技术的发展,该公司在攻克技术困难的同时也布局了相应的专利,涉及阳离子脂质的化合物结构、LNP组合物、LNP组合物配比等。部分授权专利涵盖了目前获批上市的LNP递送产品,也是目前进入LNP递送领域的企业需要重点关注的。
在阳离子脂质构效关系研究上,Alnylam做出了巨大贡献,促使了可生物降解脂质的发现。该公司也将全球首款基于LNP的siRNA产品Patisiran(Onpattro)成功推向市场,对LNP递送领域具有重要的里程碑意义。
此外,基于阳离子脂质在药物转染中的主要作用,结合临床已验证的可电离阳离子脂质(如:DLin-MC3-DMA、ALC-0315、SM-102等)的构效关系,部分企业通过微改构些许功能基团的方式,优化可电离脂质的性质以进一步提高递送效率,尤其是提高在人体肝外组织中的递送效率,据此,部分中国企业已经构建了自主研发的LNP递送平台,并逐渐进入临床前或临床研究阶段。
GalNAc递送技术
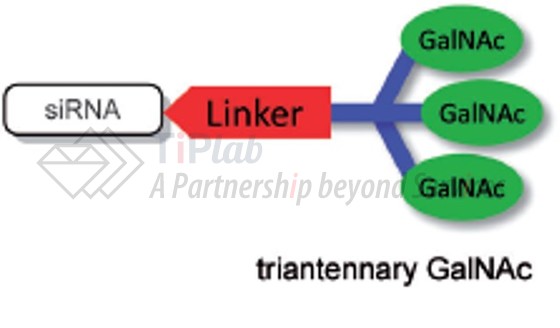
与复杂的 LNP 配方不同,GalNAc递送系统是一种更简单、更小且成分明确的肝脏递送方法。GalNAc-核酸偶联物是由GalNAc和核酸共价连接而成,其完整结构可以在固态寡核苷酸合成仪上合成并通过质谱进行化学表征。
GalNAc-核酸偶联物可分为3部分,分别为GalNAc靶头、连接臂以及小核酸分子。其中,GalNAc靶头可以与去唾液酸糖蛋白受体(ASGPR)特异性结合,实现细胞的快速胞吞,由于ASGPR主要在肝实质细胞表面高表达,因此,该技术具有高度的肝靶向特异性,给药后高效富集到肝组织,进入其他组织的量非常少。
Alnylam是最早进入GalNAc递送领域的企业之一,早在十几年前便证明具备一定结构特征的GalNAc递送系统可成功将核酸药物递送至肝脏,这一里程碑发现,促进了GalNAc递送技术的发展,截至目前,已有4款GalNAc-siRNA偶联物获批上市,均采用了Alnylam的GalNAc递送系统。
Alnylam拥有GalNAc递送技术的重要专利,涉及GalNAc靶头、连接臂、GalNAc-寡核苷酸偶联物等,这些专利给国内外进入GalNAc领域的企业造成了不小的阻碍。
机遇与挑战并存,为了共享GalNAc领域的蛋糕,当下部分创新企业致力于构建自主研发的GalNAc递送平台,同时,也有部分企业在等待早期基础专利的到期。目前,基于GalNAc递送技术,国内外已有多家企业的产品处于临床前或临床研究阶段。
小结
以上是对非病毒载体递送系统主流技术的简单介绍,接下来的系列文章中,我们将从阳离子脂质结构、LNP组合物、GalNAc递送系统的发展及结构优化等角度展开讨论,探索科学家们是如何攻克一个个技术难题以及相应代表性专利的基本情况。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
