RNAi现象和siRNA的发展史
早在1990年,人们就在矮牵牛花中观察到了基因沉默现象。
1998 年,Andrew Fire 和 Craig Mello 发表了一篇开创性的论文,将双链 RNA (dsRNA) 引入秀丽隐杆线虫后,可以通过转录后基因沉默 (post-transcriptional gene silencing,PTGS) 抑制目的基因的表达,且相比反义核酸技术,只需少量的dsRNA即可达到很好的抑制效果,他们将这种现象称为 RNA 干扰 (RNAi),并因此获得了2006年的诺贝尔奖。
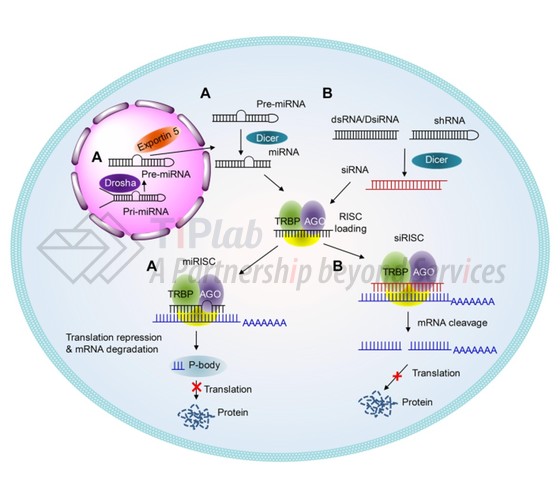
在真核细胞中,RNAi主要通过两种dsRNA分子介导,包括 siRNA (small interfering RNA,小干扰 RNA) 和 miRNA(micro-RNA),均以序列特异性方式介导靶向的 mRNA 降解(对于 siRNA 和 miRNA)或 mRNA 翻译抑制(对于 miRNA)(参见下图)以敲低靶基因的表达。
具体过程为:
1.在Dicer酶作用下,dsRNA分子被裂解为小RNA,即siRNA或miRNA;
2.dsRNA的一条链选择性掺入称为 RNA 诱导的沉默复合物 (RISC) 的蛋白质复合物中以活化RISC;
3.活化的RISC在Ago蛋白作用下与目标 mRNA 链通过碱基互补配对相互作用并使其表达沉默。
由于 siRNA 和 miRNA 之间的细微差别,siRNA 通常可以比 miRNA 触发更有效和特异性的基因沉默,而一种 miRNA 可能同时抑制几个不同靶基因的表达。在这里,我们主要针对siRNA展开讨论。
在1998年报道RNAi现象之后,早期研究描述了在不同脊椎动物系统中未能观察到序列特异性 RNAi 效应,而是证明了 dsRNA 对基因表达抑制是非特异性的且依赖于dsRNA的长度。
在2001年, Max-Planck-Institute的Thomas Tusch及其同事和 NIH的Caplen及其同事分别报道了使用化学合成的具有3’突出端的并互补配对的21 和 22 个核苷酸 (nt) 的dsRNA (即为siRNA)可以在哺乳动物细胞中诱导序列特异性的的 RNAi 沉默,而不会引发非特异性干扰素反应。之后,siRNA成为抑制基因表达的常用工具。
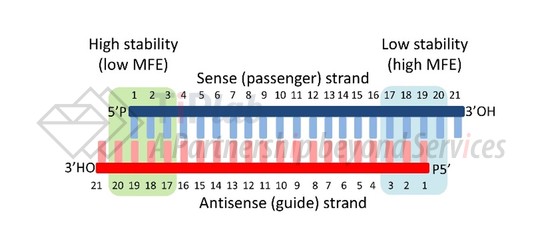
典型的siRNA结构为具有两个碱基 3ʹ 突出端的短 (19–21 bp) RNA 双链体,包括正义链(有义链)和反义链(引导链),可在没有 Dicer 切割的情况下触发 RNA 干扰。反义链上5ʹ端的第 2-8 位构成 siRNA 的种子区域,参与靶 mRNA 的初始结合。
siRNA在药物开发中的难点
作为一种“可编程”的药物,siRNA可以扩展经典小分子难以成药的靶点,在新药开发中的潜力可见一斑,但在临床应用中也面临着安全性和效力的多重挑战。
目前RNAi疗法经历了新技术触发、资本涌入的高峰和临床失败的低谷阶段,现在正接近产品收获的平台期。Alnylam无疑是RNAi 领域的领头羊,目前已经有四款产品获得FDA的批准,许多大药企和start-up也加入到这场竞争中来。
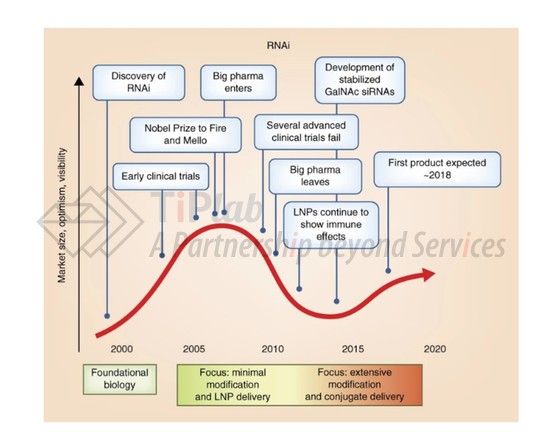
回到siRNA的开发难点上,为了实现对特定治疗靶点进行有效和特异性抑制,siRNA需要克服以下难点,包括:靶向特异性、脱靶 RNAi 活性、免疫系统介导的细胞毒性和体循环、细胞摄取和内体逃逸的药代动力学相关的挑战。这些问题可以通过结构基序、靶向序列、化学修饰以及递送途径和赋形剂的选择或工程化来解决。
在本专题中,我们主要围绕siRNA的化学修饰及其结构基序展开。
化学修饰及其结构基序
在siRNA疗法之前,另一种寡核苷酸类药物—反义寡核苷酸(ASO)疗法已经在临床上获得成功,其中涉及的寡核苷酸化学修饰方法极大地加速了 siRNA 药物的发展。然而,基于siRNA的独特性质和作用机制,这些化学修饰方法的具体应用还需要进行不断研究。
根据化学修饰的位置,我们将化学修饰方法分为磷酸酯修饰、碱基修饰和核糖修饰,化学修饰应用至dsRNA设计时,按照特定的规则,包括:修饰方式和结构设计构成了dsRNA的结构基序。
核糖修饰
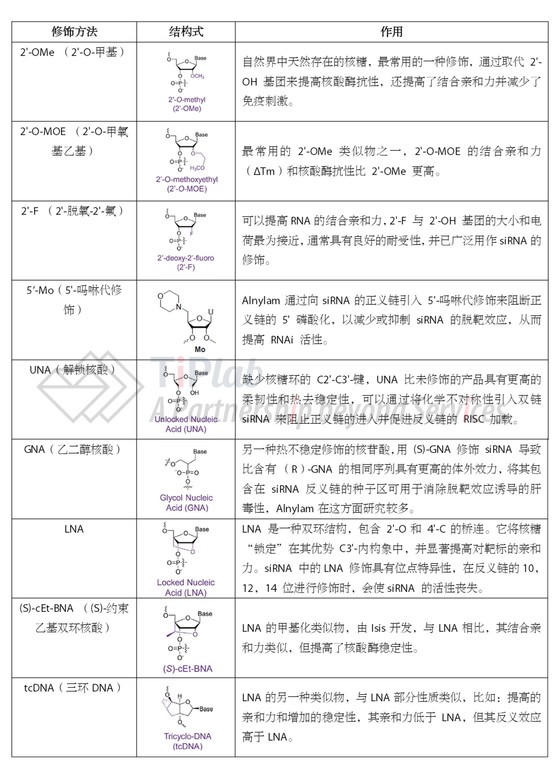
核糖修饰是指在核糖核酸的糖环的各个位置进行化学修饰。糖环修饰是siRNA 化学修饰中运用的最为广泛和成熟的方法,包括取代基修饰,比如:2’-修饰(2’-OMe,2’-F,2’-MOE)和5’修饰(5’-Mo);异构修饰,比如:UNAs、LNA、GNA、(S)-cEt-BNA、三环 DNA (tcDNA)以及这些修饰的组合修饰。
2’-糖环修饰是研究最多且运用最为广泛的修饰方法,已被广泛用于保护 siRNA 免受核糖核酸酶攻击。
磷酸酯修饰
磷酸酯修饰主要是指对siRNA上的核糖间的磷酸二酯骨架进行的修饰,主要有硫代磷酸酯(PS)、二硫代磷酸酯 (PS2)、甲基膦酸酯 (MP)、甲氧基丙基膦酸酯 (MOP) 和肽核酸 (PNA)等。另外,最近对于5’端的磷酸酯修饰是一种新开发的比较重要的修饰策略,可以增强 siRNA 活性。
磷酸骨架修饰
应用最广泛的是PS修饰技术,在上世纪90年代已广泛应用于反义寡核苷酸的修饰(参见:10.1091/mbc.9.5.1007,1998),主要用于提高核酸酶稳定性,且可能更易于与白蛋白结合从而延长其体内循环时间。但同时也会带来些不利影响,比如:降低其结合亲和力和毒性。因此,PS修饰的位置和数量对其应用至关重要,另外,根据Alnylam的研究,PS键的手性也可能会影响siRNA的性质。
5’-磷酸酯稳定化修饰
siRNA 反义链的 5’-磷酸对于 RISC 的识别是必不可少的。5’-磷酸可以通过5’-OH的胞内磷酸化或化学合成引入 5’-磷酸基团来获得,然而在体内5’-磷酸盐会被磷酸酶迅速去除,导致siRNA的活性丧失。
5’-磷酸盐的磷酸酶抗性类似物可以提高其体内功效,比如:5’-(E)-乙烯基膦酸酯 (5’-(E)-VP)、5’-甲基膦酸酯(5’-MP)、(S)-5’-C-甲基类似物和5’-硫代磷酸酯(5’-PS)都可以增加 siRNA 的体内稳定性。其中, Ionis 最早开发了疏水取代的5’-(E)-VP并将其应用至单链 siRNA (ss-siRNA) 的 5’ 末端保护siRNA免受磷酸酶的降解,且不干扰其与RISC的结合(参见:10.1093/nar/gkv162,2015),之后Alnylam等将其进一步应用于双链siRNA,发现其提高了siRNA的效力和在组织中的停留时间。
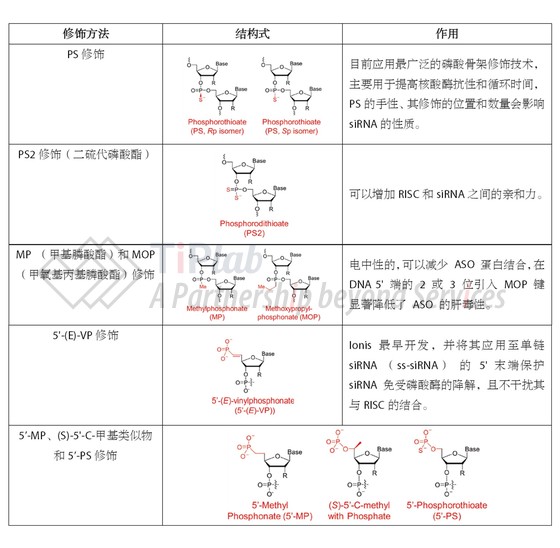
碱基修饰
siRNA 碱基修饰是指在siRNA 的碱基上进行化学修饰,主要分为嘌呤修饰,嘧啶修饰以及碱基替换三种形式。嘌呤修饰包括N6-甲基腺苷(m6A);嘧啶修饰包括5-甲基胞苷(m5C)、3-甲基尿嘧啶核苷(m3U)、5-甲基尿苷(m5U)、假尿苷、2-硫尿苷(s2U)、丙炔尿嘧啶核苷(5-pU)等修饰;碱基替换包括2,4-二氟甲苯基核糖核苷(rF)等修饰。
碱基置换可用于降低先天免疫识别和提高对核酸酶的抗性,目前在反义寡核苷酸和siRNA中的应用基本都处于研发阶段,考虑到非天然氨基酸可能被整合至基因组中的风险,人们更倾向于使用天然存在的碱基结构,例如 m5C 和 m6A 来修饰某些碱基。
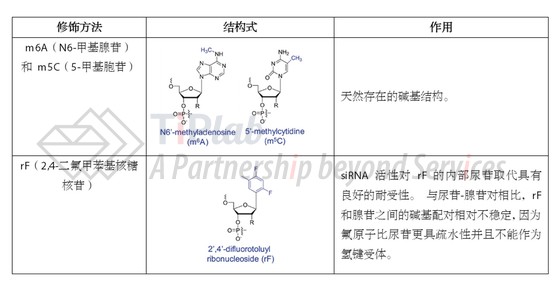
结构基序
上述我们介绍了各种具体的修饰方式,当其应用至特定的siRNA中时,需要考虑在不同位置不同数量的修饰对siRNA整体功能带来的影响,这些不同的设计规则构成了siRNA的结构基序。
早期的 siRNA通常使用 2’-OMe、2’-F 或 PS 进行部分修饰,目前的siRNA修饰几乎涵盖了其全长,并朝着多样化精细化的方向发展。
Alnylam已经开发了多种siRNA的结构基序,按照开发时间从早到晚,包括:STC(Standard template chemistry)、ESC(Enhanced stabilization chemistry)、Advanced ESC和ESC+。
目前Alnylam获批的三款siRNA药物中均使用了ESC修饰方式,ESC在STC的基础上进一步在反义链的5’-末端和正义链的3’-末端包括四个额外的PS修饰,且减少2’-F取代的数量以降低其潜在的毒性。这些变化显著增强了 siRNA 效力和持续时间。
Advanced ESC技术旨在进一步降低2’-F取代的数量,并优化2’-F取代的位置。ESC+则是在反义链的种子区域引入 GNA,可以显着减轻miRNA 样识别(即,种子区与非靶标mRNA 形成部分匹配)引起的脱靶效应并减轻肝毒性,已应用于多款临床管线的设计中。
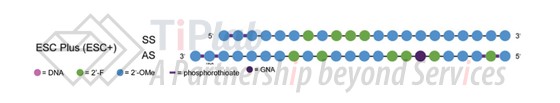
除了Alnylam之外,其他siRNA领域的公司也各自开发了独特的结构基序,比如,Arrowhead 将反向脱氧胸腺嘧啶 (idT) 置于链末端,在 UAU 或 UAUAU 基序的两侧引入 UNA等。这些设计目前正在临床试验中进行研究。
siRNA的发展与专利保护
我们从RNAi现象聊到了siRNA的开发难点,然后又针对siRNA成功开发所依赖的不同化学修饰手段进行展开,可以发现,siRNA的发展历程中见证了多个技术和商业上的里程碑事件和众多的研究成果,其实专利始终如影随形,确保了这些技术未来在商业上取得成功。
我们理解到,从技术层面来说siRNA开发涉及到的技术具有其不同的特点,在时间轴上,从早到晚包括: RNAi的机理、早期siRNA的典型结构、后期对于骨架/碱基/糖的多样化修饰以及与此同期发展的这些修饰在siRNA上的应用。结合申请人或空间维度,不同的申请人在各个国家/地域对于这些技术的保护策略和保护范围也是千差万别。也就是说,这些专利对于竞争者的阻止力度都不尽相同。
那么,对于siRNA领域的玩家们来说,这些专利都对其产品开发造成什么样的影响呢?以及如何通过获得专利保护为其他竞争者设立障碍从而参与到这个领域的竞争中去呢?
我们在接下来的系列文章中,将针对RNAi机理、早期siRNA的典型结构和siRNA的化学修饰中涉及的代表性专利进行分别介绍,以勾画出在专利保护上的要点或在产品开发过程中可能面临的风险。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
