Dynavax 目前拥有两款商业化产品:成人乙肝疫苗HEPLISAV-B®疫苗(重组乙型肝炎疫苗,佐剂型),该疫苗已在美国、欧盟和英国获批,用于预防 18 岁及以上成年人感染所有已知亚型的乙型肝炎病毒和 CpG 1018®佐剂。
Dynavax 的带状疱疹疫苗候选产品Z-1018目前处于 1/2 期临床开发阶段。
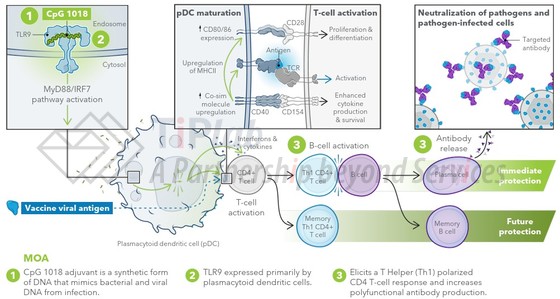
Dynavax的重点技术是开发基于Toll 样受体(TLR)激动剂作为佐剂,与疫苗中的特定抗原结合使用,以帮助刺激针对该抗原的免疫反应。Dynavax 已鉴定出专有的合成寡核苷酸(即,短 DNA 片段),能够选择性地、高效地激活Toll样受体。
- TLR是一类跨膜蛋白,表达于树突状细胞和其他固有免疫细胞上,通过激活特定的 TLR,可以刺激和控制特定类型的固有免疫反应,进而增强适应性免疫反应。
其领先的产品CpG 1018 佐剂是TLR9 激动剂,TLR9 只在少数几种关键免疫细胞类型(主要是树突状细胞)中表达,从而可以实现靶向激活。此外,Dynavax 正在开发能够激活TLR7 和 TLR8 的激动剂,助力 Dynavax 开发出高效疫苗。
CpG 1018 佐剂是一种含有未甲基化 CpG 基序的合成寡脱氧核苷酸(CpG ODN),由 22 个核苷酸的硫代磷酸酯连接的寡脱氧核苷酸组成,序列为5’-TGACTGTGAACGTTCGAGATGA-3’。CpG 1018可以模拟细菌和病毒的遗传物质,从而选择性激活 TLR9,诱导T 辅助 (Th1) 极化的 CD4 T 细胞反应,并增加多功能抗体的产生。Dynavax还与多家合作伙伴基于 CpG 1018 佐剂共同开发疫苗产品,比如,新冠疫苗。
HEPLISAV-B 特点是只需在一个月内接种两剂,与其他乙肝疫苗(需在六个月内接种三剂)相比,能够更快地达到较高的血清保护水平。预计到 2030 年,HEPLISAV-B 在美国的收入将超过 9 亿美元。
HEPLISAV-B 是一种成人乙型肝炎疫苗,由纯化的乙型肝炎表面抗原 HBsAg 与 CpG 1018佐剂在磷酸盐缓冲盐溶液中配制而成,以增强免疫反应。HEPLISAV-B 是一种预充式注射剂,适用于 18 岁及以上成年人,用于预防乙型肝炎病毒感染。
- 乙肝病毒的传染性比艾滋病毒高出100倍,而且传播还在不断增加。乙肝病毒在体外至少可以存活7天。在此期间,病毒仍然具有感染能力。世卫组织估计,2022 年全球约有 2.54 亿人患有慢性乙型肝炎,同年约有 110 万人死于乙型肝炎,其中大部分死于肝癌。
在专利组合上,Dynavax的核心产品(即,HEPLISAV-B疫苗和CpG 1018佐剂)没有活性成分专利保护,目前商业化产品和在研产品主要依赖大量涉及含有TLR激动剂或拮抗剂的组合物、其用途和工艺专利,这些专利涵盖疫苗、肿瘤免疫等场景。
据Dynavax披露,截至2024年12月31日,共有包括多于65件已授权专利(其中包括多于20项US专利和45项US以外的专利)以及多于130件由Dynavax独家拥有或与合作者共同拥有的在审专利申请。
- 目前有3件已授权US专利涵盖HEPLISAV-B疫苗的相关用途,将于 2032 年到期;
- 部分专利申请涉及CpG 1018和在研带状疱疹疫苗、COVID-19疫苗、鼠疫疫苗的组合物和使用方法。
- 部分专利和专利申请涉及已终止的疫苗项目和肿瘤免疫项目。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
