在RDC领域,由于放射性核素的衰变会持续释放高能辐射,可能诱导RDC药物分子的化学键断裂,影响放射性核素的靶向精准性,进而减低药物诊断或治疗功效。因此,开发稳定且安全的RDC制剂至关重要。
当企业确立药物制剂方案之后,可以对其进行专利保护。一方面,如果申请人之前已经获得了RDC活性分子专利,通过申请新的制剂专利,可以延长RDC药物的专利保护时间,从而延长市场独占期,有效延缓仿制药竞争。另一方面,由于市场对RDC药物的辐解稳定性等需求,通过制剂专利覆盖关键的工艺参数(剂型特征、辅料种类等),申请人可以构建难以规避的技术壁垒。
在探讨制剂专利的专利保护时,需基于技术效果出发确定其保护形式。如果RDC制剂稳定且安全的技术效果源于添加剂,则保护形式应为组合物,且需要明确具体的添加剂;如果效果是源于特殊的制备工艺,则保护形式应为制备方法,且需要包括能够实现效果的关键步骤。本文聚焦于组合物的保护形式,深入探讨其保护范围和可专利性问题。
基于技术效果确定保护范围
对于组合物的专利保护形式,根据技术效果不同,其对应的保护范围也不同。下面我们用两个案例来说明如何确定保护范围。
案例1:代表性RDC药物Lutathera衍生的制剂专利家族
PCT/IB2018/057415专利家族(申请日2018年9月25日)围绕包含Lutathera的制剂产品进行了保护。在该专利家族中,所解决的技术问题是RDC药物的辐解稳定性,申请人通过添加较低浓度稳定剂,增加RDC药物的放射化学稳定性。在该方案中,技术效果体现在具体浓度的稳定剂添加剂减少放射性核素的辐解,而非放射性核素如何实现其精准靶向性。因此,围绕辐解的技术效果,相应的保护范围应为限定具体浓度(1.0-5.0mg/mL)的稳定剂(龙胆酸和抗坏血酸),以及实现稳定剂效果必不可少的组成部分种类(177Lu+DOTA+肽)。参见家族成员US10596278B2。

案例2:RDC药物AAA603([177Lu]NeoBOMB-1)衍生的制剂专利家族
PCT/EP2019/077569专利家族(申请日)围绕包含AAA603的制剂产品进行了保护。在该专利家族中,所解决的技术问题是AAA603很容易粘附在玻璃和塑料表面,会产生影响药物剂量准确性等不利后果。申请人通过添加表面活性剂降低了AAA603在容器上的附着。在该方案中,技术效果体现在表面活性剂的添加能够降低附着。因此,围绕降低附着的技术效果,相应的保护范围应为限定能够降低附着的表面活性剂种类,以及可能会附着在容器上的RDC组成部分。参见家族成员CN113195005B。
当企业确认RDC制剂方案后,需要首先确认方案中添加剂所要解决的技术问题以及带来的技术效果是什么,以及所涉及的RDC组成部分是哪些,并在权利要求中有针对性的进行限定。对于添加剂所产生的不同技术效果,可以划分出不同的保护范围。
RDC制剂产品的可专利性问题
在RDC制剂产品中可能遇到的审查问题,同样需要从技术效果出发。
1. 创造性
在RDC药物开发中,RDC制剂研究通常处于研发后期,且添加剂的种类和功效已有较为完善的研究,因此制剂专利申请时,现有技术相对较多,常面临“创造性”挑战。
在案例1中(PCT/IB2018/057415专利家族),由于龙胆酸和抗坏血酸属于已知可抗辐射分解的稳定剂,在申请过程中遇到了创造性挑战。
对比文件1(Chen等人,US 2007/0269375A1)公开了包含放射性金属(例如177Lu等)、螯合剂(如DTPA、DOTA等)、稳定剂(如龙胆酸、抗坏血酸等)和靶向部分(例如生长抑素)的稳定放射性药物制剂,其中稳定剂龙胆酸(例如3 mg/mL,10 mg/mL)和抗坏血酸(例如25 mg/mL,50 mg/mL)可以单独或组合使用。
对比文件2(Maus等人,Int.J.Dgnost.Imaging,2014,1,5-12)公开了使用龙胆酸和抗坏血酸来作为淬灭剂(将激发态物质转化为基态的添加剂)能够减少177Lu-DOTATATE辐解的影响,且使用龙胆酸和抗坏血酸后,在放射性标记后72小时仍能保持95%的放射化学纯度。
审查员认为申请技术方案中的技术特征(RDC制剂组合物包括177Lu+DOTA+肽,并添加1.0-5.0mg/mL的龙胆酸和抗坏血酸)已被两篇对比文件公开。
然而,判断技术方案是否有创造性,关键在于是否有动机将对比文件进行组合,以及是否能够合理预期对比文件组合后的技术效果。
在RDC领域,同样的稳定剂与不同放射性药物组合后,对RDC具体哪个部分起到稳定作用可能会产生很大差异。在对比文件1和对比文件2中,加入龙胆酸和抗坏血酸的效果为减少对特异性靶向配体的放射损伤。并且对比文件2进一步公开了不能使用较低浓度的龙胆酸和抗坏血酸。
而在本申请中,添加龙胆酸和抗坏血酸的效果是降低对整个RDC药物组成部分的损伤 ,在生产结束后至准备注射的时间内维持活度为7.4GBq以上,满足临床使用需求,并且申请方案中使用的是较低浓度的稳定剂(1.0-5.0mg/mL)。在实施例中,添加稳定剂后RDC整体结构的放射化学稳定性高达250-500MBq/mL。
因此,本领域技术人员无法预期添加了较低的稳定剂浓度后能够实现好的RDC放射化学稳定性。本申请的技术方案具有创造性。
在案例2中(PCT/EP2019/077569专利家族),由于所限定的RDC活性成分和表面活性剂种类也已被公开,同样遇到了创造性问题。 对比文件1(WO2014052471A1)公开了放射性药物[177Lu]NeoBOMB-1;对比文件2(“EXCIPIENTS USED IN BIOTECHNOLOGY PRODUCTS”, Eva Y. Chi,《Pharmaceutical Excipients:Properties, Functionality, and Applications in Research and Industry》)公开了表面活性剂(聚山梨醇20和80)可以降低蛋白质的固体表面吸附。
同样地,判断创造性需要从技术效果出发。本申请所要解决的是AAA603(一种GPRP拮抗剂)的一个特定技术问题:对小瓶塑料表面的粘附,对比文件并不涉及该技术问题。并且对比文件2属于生物技术产品中赋形剂的技术领域,与要求保护的发明不同。本领域技术人员没有理由将对比文件结合,技术人员将表面活性剂用于GPRP拮抗剂相关制剂中作为稳定剂的方案不具有启示,更无法预期添加了表面活性剂后能够减少GRPR拮抗剂对小瓶塑料表面的附着。
2. 支持性
在确定保护范围时,如果对RDC药物组成部分中与技术效果密切相关的组成部分以及添加剂种类未进行明确限定,可能会遇到“支持问题”。
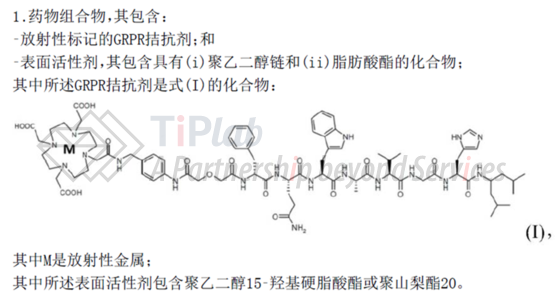
比如,在案例2中(PCT/EP2019/077569专利家族,公开号),申请人最初试图在RDC药物部分保护通式,覆盖多种GRPR拮抗剂(拮抗剂通式)和多种表面活性剂(包含具有(i)聚乙二醇链和(ii)脂肪酸酯的化合物的表面活性剂)的组合,参见家族成员公开号CN113195005A。

在申请实施例中,仅验证了不同表面活性剂对具体的GRPR拮抗剂附着情况的影响,根据肽性质的不同,无法预期所有GPRP拮抗剂和表面活性剂均可以解决特定GRPR拮抗剂在容器上的附着的技术问题。
最终申请人将GRPR拮抗剂的结构限定为具体的化合物,并将表面活性剂限定为实施例中涉及的两种表面活性剂,即聚乙二醇15-羟基硬脂酸酯或聚山梨酯20,以及可能会附着在容器上的具体的GRPR拮抗剂组成。
从添加剂技术效果出发构建RDC制剂专利策略
综上所述,在RDC领域,从制剂角度出发可以保护RDC药物与添加剂的组合 。具体而言,这一类申请需要从添加剂所带来的技术效果出发,限定添加剂(例如添加剂浓度、多种添加剂间的比例等)及RDC药物(例如靶向配体、螯合剂种类等)的关键技术特征。
在RDC制剂保护过程中,通常还会遇到“创造性”问题和“支持”问题,相应审查问题的判断标准需要从技术效果出发进行考量。
对于“创造性”问题,申请人在准备申请文件前需要充分考察现有技术情况,判断现有技术是否解决同样的技术问题,以及针对该技术问题是否产生了同样的技术效果 。当现有技术解决的技术问题与该申请属于不同的领域(例如生物技术产品赋形剂和RDC制剂),或者该申请产生预料不到的技术效果(例如现有技术无法预期低浓度稳定剂能够提供很好的放射化学稳定性),那么可以说明该申请具有创造性。
对于“支持”问题,申请人在布局过程中尤其需要考虑申请文件中的技术效果是什么(例如RDC药物的放射化学稳定性),以及与技术效果密切相关的技术特征(例如稳定剂种类和浓度)是否进行了限定,从而满足支持性的要求。
对此,申请人需要基于技术效果确认保护范围,并提前做好战略布局,从而获得高质量、高价值的专利,提升企业的核心竞争力。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
