溶瘤病毒重新吸引业界关注
近日,溶瘤病毒重新吸引了工业界和学术界的目光,一些制药巨头先后完成了几笔相关收购,比如:
2018年5月份,强生宣布斥资10亿美元收购一家制造溶瘤病毒的公司—BeneVir。
2018年2月份,Merck也收购了一家位于澳大利亚的开发溶瘤病毒的公司—Viralytics,目前正在进行溶瘤病毒与Keytruda®联用的早期临床试验。
早在一个世纪以前,人们就认识到病毒具有杀死癌细胞的潜力,不过当时无法很好地控制病毒的毒性也无法实现其在癌细胞中进行选择性复制,因此溶瘤病毒作为药物的概念一度被搁置。
直到近十年来,随着人们对于病毒生物学和肿瘤免疫学的深入认识,通过对病毒基因组进行改造之后,溶瘤病毒的安全性和治疗潜力在临床试验中才得以验证,对溶瘤病毒这一新疗法的兴趣也日渐增加。
与靶向药物相比,溶瘤病毒的优势在于,病毒可以进行复制并以多种方式攻击肿瘤细胞 (如:裂解细胞、刺激免疫应答等),因此不容易产生耐药性,而靶向类药物则通过靶向单个靶点来杀伤肿瘤细胞,治疗效率较低。
Imlygic®
Imlygic® (活性成分:Talimogene laherparepvec,T-VEC)是一种减毒1型单纯疱疹病毒 (Herpes simplex virus type 1,HSV1),通过基因修饰实现在肿瘤细胞中选择性复制,并表达GM-CSF (Granulocyte-macrophage colony-stimulating factor)。T-VEC通过双重机制介导抗肿瘤活性:一方面,通过在肿瘤细胞中复制,导致肿瘤细胞裂解,并释放肿瘤相关抗原,从而促进抗肿瘤免疫应答;另一方面,T-VEC释放的GM-CSF可以招募树突细胞和巨噬细胞来杀伤肿瘤细胞。
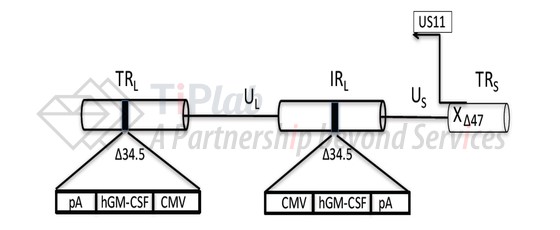
T-VEC最初由BioVex开发,2011年,Amgen以高达10亿美元的价格收购了BioVex。T-VEC来源于JS1病毒株,其修饰过程如下:
正常细胞在遭受病毒感染后会激活抗病毒通路,从而限制病毒的传播并促进感染细胞的凋亡或坏死,HSV-1的毒性是由ICP34.5蛋白 (Infected cell protein 34.5)介导,可以通过阻断细胞的抗病毒通路以感染正常细胞。T-VEC中编码ICP34.5的基因被删除,以消除HSV-1感染正常细胞的能力。一些癌细胞的抗病毒通路存在异常,可以通过下调某些关键的信号传导组分,使其更容易被病毒感染,因此,ICP34.5缺失的T-VEC仍然可以感染癌细胞,从而实现在癌细胞中选择性复制的能力。
为了进一步提高T-VEC的溶瘤能力,编码ICP47 (一种阻断抗原呈递的蛋白)的基因也被删除,从而增强病毒抗原的呈递。此外,ICP47的缺失还诱导US11蛋白 (Unique short 11 glycoprotein)早期表达量的上调并通过阻断抗病毒通路来促进病毒在癌细胞中进行复制。
GM-CSF是一种能够促进树突细胞聚集和成熟的细胞因子,将编码GM-CSF的基因插入到ICP34.5缺失的位置,从而增强抗原提呈并刺激T细胞免疫应答。经修饰的T-VEC感染癌细胞之后,可以逆转免疫抑制的肿瘤微环境,诱导抗肿瘤免疫反应。
在一项临床2期实验中,使用T-VEC治疗不可切除的转移性黑色素瘤患者获得了26%的整体响应率。黑色素瘤本身对免疫治疗的响应性较高,因此可以诱导抗肿瘤免疫反应的T-VEC取得如此治疗效果也不足为奇。
2015年,FDA批准T-VEC用于治疗不可切除的术后复发的黑色素瘤,以品牌名Imlygic®进行销售,给药方式为瘤内注射,是FDA批准的首个溶瘤病毒。

目前,Amgen还正在进行T-VEC治疗转移性黑色素瘤的3期临床试验,以及与PD-1拮抗剂Keytruda®联用治疗中晚期转移性黑色素瘤的1b/3期临床试验。
保护T-VEC的专利
伦敦大学的Robert Coffin等人首先设计了T-VEC,并在2000年创立了BioVex公司。2001年,BioVex在同一天递交了两个分别涉及疱疹病毒本身 (PCT/GB2001/000225)和经修饰的病毒株用于癌症治疗用途 (PCT/GB01/00229)的PCT专利申请,并要求相同的优先权,两个PCT专利分别进入美国国家阶段,并以此衍生出了保护T-VEC的一个大的专利家族。
以US7223593B2为母案的专利家族
母案
PCT/GB2001/000225首先进入美国国家阶段并获得了授权—US7223593B2,权利要求1保护:
“A herpes simplex virus which:
comprises a gene encoding an immunostimulatory protein;
lacks a functional ICP34.5 encoding gene and a functional ICP47 encoding gene;
is replication competent in tumor cells; and
is derived from HSV1 JS1 as deposited at the European collection of cell cultures (ECAAC) under accession number 01010209.”
US7223593B2的权利要求1保护一种单纯疱疹病毒,限定了病毒的功能和结构,T-VEC刚好落在US7223593B2的保护范围。US7223593B2针对Imlygic®获得了1766天的专利期延长,专利保护期将至2025年11月。
延续案
随后,申请人以US7223593B2为母案陆续递交了一系列的延续申请,保护范围涵盖治疗方法、组合物和病毒本身等。
其中一部分已获得授权,比如:
US8277818B2保护一种包含病毒的组合物,并对病毒的结构和功能进行了具体的限定—包含GM-CSF、缺少ICP34.5和ICP47基因、在感染的肿瘤细胞中具有复制能力,对T-VEC进行了更为“精准”的保护。
US8680068B2则保护使用如US8277818B2中涉及的病毒治疗癌症的方法,同时限定给药方式为瘤内注射,与FDA批准的药品说明书中的内容一致。
此外,部分专利申请仍处于审查阶段,比如:
US20150232812A1涉及一种HSV1,对免疫调节蛋白基因进一步限定为在启动子的控制下进行表达。
BioVex围绕US7223593B2递交的一系列衍生专利,以不同类型和范围的权利要求对T-VEC进行了保护。
以US7063835B2为母案的专利家族
母案
随后PCT/GB01/00229也进入了美国国家阶段并获得授权 (US7063835B2),保护使用HSV1治疗癌症的方法,权利要求1保护:
“A method of treating a tumor in an individual in need thereof, comprising the step of administering to said individual an effective amount of an oncolytic herpes simplex virus 1 strain (HSV1), wherein said oncolytic (HSV1) strain is a clinical isolate from a recurrent cold sore modified such that it lacks a function ICP34.5-encoding gene, wherein said modified clinical isolate has a greater ability than a reference laboratory HSV strain modified in the same manner as the clinical isolate to replicate in or kill tumor cells, and wherein said reference laboratory strain is selected from the group consisting of HSV1 strain 17+, HSV1 strain F and HSV1 strain KOS.”
US7063835B2对HSV1的结构 (缺少ICP34.5基因)和功能 (比参照病毒株的复制和杀伤肿瘤细胞的能力更强)进行了限定,没有限定疾病的具体类型,也就是说使用如权利要求中限定的HSV1治疗癌症都会落在US7063835B2的保护范围中。
PCT/GB01/00229也进入了中国国家阶段并获得了授权 (CN1250732C),权利要求1保护:

CN1250732C的权利要求1保护JS1毒株或由其衍生的HSV1毒株,其它独立权利要求还保护了其药用组合物和治疗癌症的用途。
分案及延续案
US7063835B2的分案US7537924B2保护一种HSV1毒株,并包含一些基因缺失。
延续案US20140154216A1涉及一种治疗用途,仍处于审查阶段。
US7223593B2和US7063835B2衍生的专利大家族的到期日将至2021年以后。
保护T-VEC的其它专利
Amgen还申请了保护T-VEC的其它专利,包括联合用药专利或制剂专利等。比如:
US20150202290A1涉及使用免疫检查点抑制剂和单纯疱疹病毒治疗黑色素瘤的联合疗法,仍处于审查阶段,同族的中国专利CN104704002A也处于审查阶段。
US20170360857A1以及同族的中国专利CN107580626A涉及单纯疱疹病毒的制剂,都处于审查阶段。若获得授权,可将T-VEC的保护期延长至2035年。
溶瘤病毒的未来可期
未来免疫检查点抑制剂与溶瘤病毒联用将成为一种趋势:
溶瘤病毒主要通过激活免疫反应杀伤肿瘤,小鼠实验表明将免疫检查点抑制剂与溶瘤病毒协同施用可增强对肿瘤的免疫应答。2017年公布的一项临床试验结果显示,使用T-VEC与检查点抑制剂联用治疗晚期黑色素瘤患者后,62%患者的肿瘤体积变小。
当然,溶瘤病毒也存在些局限,比如,不适合进行静脉注射给药,静脉给药容易产生循环抗体,从而降低疗效。
其实,中国早在2005年就批准过一款溶瘤病毒H101—E1B缺失的腺病毒,用于治疗头颈癌和食道癌,只不过由于治疗效果平平未受关注。
相信随着人们对溶瘤免疫疗法的进一步探究以及T-VEC取得的成功,这些经过精确修饰的溶瘤病毒会成为癌症治疗的一个利器。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
