最近数年来,细胞和基因疗法(CGT)正逐步展现其革命性的潜力,多种新技术获批,还有更多的技术正在开发中。其中,基因编辑技术由于其改变潜在基因序列的能力,为此前治疗希望渺茫的患者提供了改善或者治愈的可能性,成为了聚光灯下的焦点。
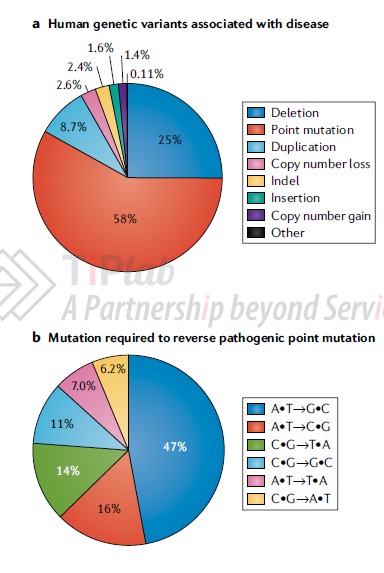
在众多导致人类疾病的基因序列突变中,碱基的点突变又是引发人类遗传疾病的主要原因之一。有数据表明,在已知的人类致病突变中,大约58%都是由点突变引起的;而在这些点突变的可能“纠错”方式中,需要将A•T碱基对转化为G•C碱基对的比例约占一半,紧随其后的是A•T碱基对到C•G碱基对的转化,以及C•G碱基对到T•A碱基对的转化,分别为16%和14%。因此,如果有一种基因编辑工具能够有效地“纠错”点突变,或者至少可以“纠错”那些占比较高的点突变,将有望为更多的患者带来希望。
我们接下来要探讨的DNA碱基编辑技术就是这样一种基因编辑工具,它可以对基因组上的单碱基进行编辑,这一技术的出现时间虽然不算很长,但已成为众多基因编辑技术中不能忽视的重要成员,一个游戏规则改变者。
经典的DNA碱基编辑器是由哈佛大学教授、Broad研究所核心成员David Liu开发的胞嘧啶碱基编辑器(CBE,2016年)和腺嘌呤碱基编辑器(ABE,2017年),分别针对前述的C•G到T•A的转化(14%),以及A•T到G•C的转化(47%)。这一革命性的技术一经问世就获得了众多关注,并在随后的几年中不断改进。例如,David Liu发现脱氨酶融合尿嘧啶糖基化酶抑制剂(UGI)可以将CBE的编辑效率提高3倍(doi:10.1038/nature17946),并且发现相较于只融合一个UGI,融合两个UGI编辑效率能进一步提高。
与此同时,碱基编辑技术的商业化进展也非常迅速。ABE推出的第一年,也就是2017年,David Liu、张锋、J. Keith Joung就携手创立了Beam公司;到了2020年,Beam成功上市。
回到技术本身,DNA碱基编辑技术脱胎于CRISPR/Cas系统,CRISPR/Cas系统由核酸酶(例如,Cas9)和sgRNA两部分组成。核酸酶和sgRNA负责定位和识别靶基因,之后,核酸酶对双链DNA进行解旋并剪切,并通过DNA修复过程实现基因编辑。
而DNA碱基编辑技术在核酸酶和sgRNA的基础上,又增加了新的脱氨酶部分,并使核酸酶失去剪切活性。首先,在sgRNA的引导下,失活的核酸酶定位识别并结合基因组的特定位点并将双链DNA解旋,之后,脱氨酶可以在特定的编辑窗口内编辑单碱基,实现碱基的转换。
经过几年的发展,越来越多的公司已经尝试利用DNA碱基编辑技术开发他们的新疗法。我们已经知道,碱基编辑器既与CRISPR/Cas系统有着千丝万缕的关系,又有他们的独特之处,因此,碱基编辑器既有CRISPR/Cas系统带来的风险,又有他们独特的脱氨酶带来的风险。另外,碱基编辑器整个系统也会带来风险。前述提到近几年碱基编辑器不断优化,这些优化也会带来相应的风险。
那么,这些风险该如何解决呢?对于不同类型的公司,风险解决方式有何差异?我们希望通过本系列的研究,能围绕这些问题进行探讨,希望给大家一些启发。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
