GalNAc概述
GalNAc(N-乙酰半乳糖胺)是去唾液酸糖蛋白受体(ASGPR)的高亲和力靶向配体。ASGPR是一个主动靶向的理想受体,它在肝细胞表面特异性高表达,与GalNAc结合后,通过细胞内吞作用,进入到细胞内形成内涵体,从而将足够数量的核酸药物带入细胞内,实现核酸药物的肝靶向递送。
GalNAc目前主要应用于siRNA或ASO的递送,可以与siRNA或ASO药物形成缀合物,利用GalNAc与肝细胞特异性表达的ASGPR之间的结合能力,将药物精准地递送到肝脏中。
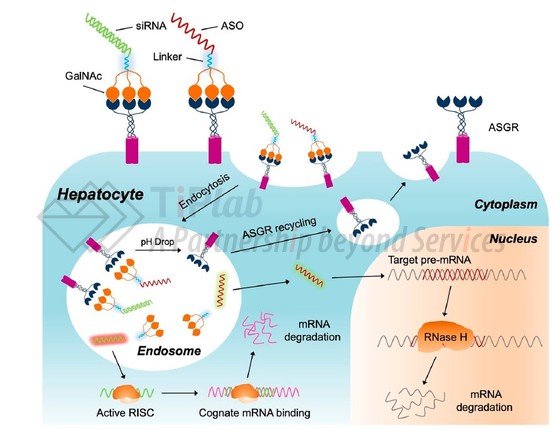
基于GalNAc递送技术,首款产品于2019年获批上市,截至目前,已有4款GalNAc-siRNA偶联物产品进入市场,Alnylam均参与了产品的开发及推广。

上述4款GalNAc-siRNA偶联物,结构均由3部分组成,分别为三触GalNAc靶头、连接臂以及siRNA分子。GalNAc以三触形态共价偶联到siRNA的正义链3’末端,形成GalNAc-siRNA偶联物。
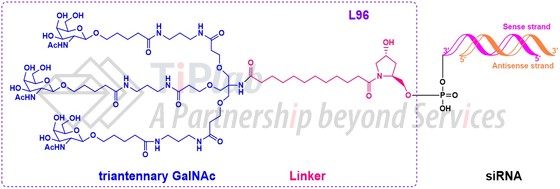
GalNAc递送系统的发展及结构特点
早在1971年,Rogers等人就披露ASGPR与去唾液酸胎球蛋白(asialofetuin,一种特定的ASGPR配体)结合可成功将非糖蛋白活性物质递送至肝脏,证实了ASGPR的临床可能性。
随后几十年,为筛选高亲和力靶向ASGPR 的特异性配体,科学家们先后研究了触角数量、糖分子类型、糖残基之间的空间距离、连接糖残基和分支点的臂的灵活性、配体的颗粒大小等因素,优化获得了三触GalNAc递送系统,为后续基于ASGPR/GalNAc的应用研究奠定了理论基础。
三触GalNAc应用于核酸药物递送
1993年,Berkel课题组就披露了三触半乳糖(galactose,简称Gal)偶联物可成功向肝脏递送活性药物,其中,活性药物包含核酸类似药物。据此递交了相应的专利家族进行保护,该家族已于2013年到期。
可见,早在上世纪90年代,三触GalNAc递送系统用于向肝组织递送活性药物已经初见雏形,直到2008年,Alnylam证明具备一定结构特征的GalNAc-siRNA偶联物可成功向肝脏递送核酸药物,相应专利家族为PCT/US2008/085574(以下简称‘574家族)。目前‘574家族已有多件专利获得了授权,部分涵盖已获批上市的GalNAc-siRNA偶联物或其GalNAc递送结构L96。
重要家族成员US8828956B2,保护了一种修饰的RNA剂,并限定修饰RNA的所有核苷酸糖(nucleotide sugars)都被修饰,授权权利要求1如下:
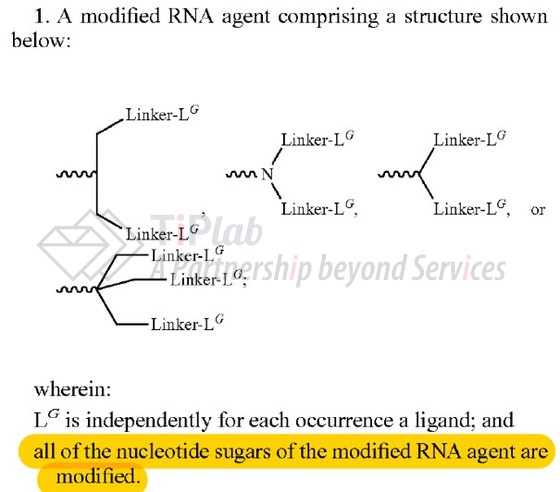
从上述专利的权利要求来看,若RNA试剂的所有核苷酸糖部分都进行了修饰,且递送部分包含上述二触或三触结构均可能会落入其范围内,相应产品将存在潜在的自由实施风险。
除上述二触或三触GalNAc外,‘574家族还保护了一类新型多价GalNAc,比如:“(1+1+1)三价GalNAc”(也称non-nucleosidic trivalent GalNAc),代表性专利为US9867882B2,其权利要求1保护一种包含一个或多个缀合物的寡核苷酸,且各单价GalNAc之间由磷酸酯连接,缀合物通式为:
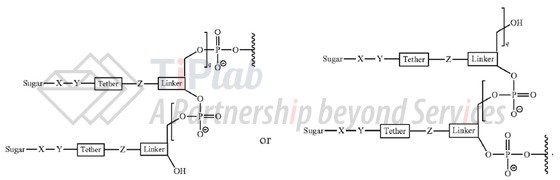
对于(1+1+1)三价GalNAc,Alnylam在2015年的文章中披露,其保持了最佳触角数量、空间方向和糖残基之间的空间距离,可与ASGPR 准确识别;该结构可通过固相合成产生,相对于三触GalNAc其合成步骤更少;此外,若将该(1+1+1)三价GalNAc共价连接到siRNA正义链的3’端,与三触 GalNAc 偶联物相比,体外和体内效果相似(DOI:org/10.1002/cbic.201500023,Alnylam)。

除上述专利代表专利外,‘574家族含有多篇授权专利保护不同靶点的GalNAc递送系统、GalNAc特征连接臂、GalNAc-siRNA修饰等,可见,Alnylam对GalNAc的专利布局较为全面。
随着Alnylam在GalNAc领域的成功,国内外其他致力于RNA疗法的企业,如Ionis、Arrowhead、Dicerna等也纷纷进入GalNAc领域,并构建了自己的GalNAc递送系统。
其他公司的GalNAc递送系统
以下,我们将介绍2种分别由Dicerna和Arrowhead自主研发的GalNAc递送系统,这2种系统区别于Alnylam的三触GalNAc结构,各自都具有显著的结构特征。
Dicerna的GalXC™平台
Dicerna是一家专注于研发试验性RNAi治疗药物的生物医药公司,拥有能够实现肝脏靶向(GalXC™)和肝外靶向(GalXC-Plus™)的递送平台,基于2款递送平台能极好地补充诺和诺德现有的肝脏治疗管线,在2021年该公司被诺和诺德以33亿美元高价收购。

肝脏靶向的 GalXC™递送平台可实现 RNAi疗法的皮下给药,该平台利用了GalNAc较高的肝脏选择性实现精准递送,构建了结构特异的siRNA,其包含单价GalNAc偶联的四环(tetraloop)结构。
区别于Alnylam的三触GalNAc递送系统,GalXC™在过客链中引入了独特的四环结构,可增强偶联物的稳定性,同时,还能准确定位多个GalNAc配体,将siRNA成功递送至肝细胞。
目前,Dicerna进入临床阶段的产品Nedosiran(DCR-PHXC)、RG6346(DCR-HBVS)和Belcesiran(DCR-A1AT)均利用GalXC™技术开发而成。
对GalXC™递送平台,早在2015年,Dicerna便已对其进行了保护,相关专利家族风险将持续到2035年,其代表性专利的授权权利要求范围较宽,限定特征包含正义链、反义链及其互补部分的碱基长度、特征四环的序列、四环与GalNAc缀合数目等,能涵盖多个技术方案,因此,后续若想构建类似于GalXC™的递送平台,建议针对保护GalXC™递送平台的专利家族进行规避设计。
除Dcierna外,Arrowhead也基于ASGPR/GalNAc递送原理开发了区别于三触GalNAc的递送系统,目前也处于临床阶段。
Arrowhead的DPC™和TRiM™递送系统
Arrowhead的Dynamic PolyConjugates(DPC™),是另一款将siRNA递送至肝细胞的递送系统。DPC™递送平台的核心特征是含有丁基氨乙烯基醚的聚合物PBAVE(polymer composed of butyl and amino vinyl ether)。
PBAVE具有感应内涵体/溶酶体pH而促进逃逸的能力,GalNAc修饰的PBAVE可通过二硫键与siRNA偶联形成DPC™-siRNA复合物,也即第一代DPC™递送系统(Prototypical DPC)。
随后,Arrowhead开发了第二代DPC™递送平台(DPC polymer+targeted siRNA),第二代技术中siRNA不用二硫键与PBAVE键合,而是直接将胆固醇修饰的siRNA(Chol-siRNA)与PBAVE聚合物通过共注射的方式进行给药。基于此,Arrowhead开发了治疗慢性HBV的药物ARC-520,该产品在临床II期时被FDA叫停,推测是DPC™平台毒性所致。
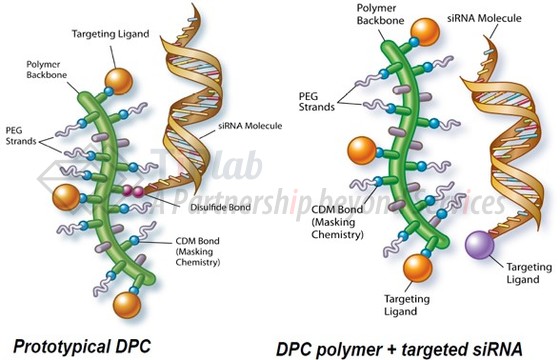
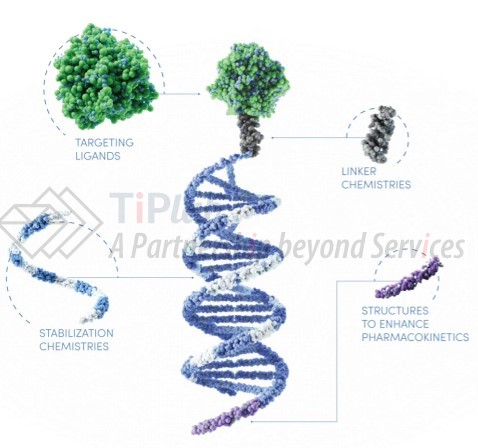
DPC™不理想的实验结果,并未阻碍Arrowhead不断创新的步伐,基于过去十多年在靶向药物递送载体上的研发经验,Arrowhead构建了全新的递送平台TRiM™(Targeted RNAi Molecule),该平台去除了有问题的活性内体逃逸剂 (PBAVE、MLP),有利于靶向配体与目标受体的直接结合。
TRiM™包含一个高效的RNA trigger,根据需要,针对不同的候选药物可针对性的优化以下组件:高亲和力靶向配体、连接子、稳定的候选RNA药物、增强药代动力学的结构。通过改变与RNA分子偶联的靶向配体,该平台能够将RNAi疗法特异性地递送到不同的组织中,从而实现治疗不同类型疾病的目的。
基于TRiM™平台,Arrowhead已开发了十几款产品,涉及肝脏、肺、肌肉和肿瘤等组织,其中,靶向配体为GalNAc的相关产品有ARO-HBV(JNJ-3989)、ARO-AAT(TAK-999)和AMG-890(Olpasiran)。该三款产品均已进入临床II期(信息来自Arrowhead官网),并分别与Janssen Pharmaceuticals、Takeda和Amgen达成合作协议,Arrowhead从交易中获得的潜在价值高达数十亿美元。
小结
GalNAc偶联技术正在成为将治疗性核酸,特别是siRNA递送到肝细胞的主要策略,从上面的介绍中可以看出,目前来自三触GalNAc递送系统的基础专利风险将至少持续到2028年,相应风险专利主要掌握在Alnylam手中。
由于三触GalNAc递送系统已经经过临床验证,当下研究肝脏相关疾病的部分企业大多会以三触GalNAc递送系统的结构为基础,调整部分功能基团,从而构建自己的三触GalNAc递送系统,此时我们需要重点关注来自Alnylam基础专利家族的风险。
此外,除了典型的三触GalNAc递送系统外,国内外企业基于ASGPR/GalNAc递送原理,也构建了与三触GalNAc结构存在显著区别的GalNAc递送系统,并且有部分产品已进入临床II期或III期,未来应用前景可观。
当下GalNAc递送领域已有多家企业构建了三触GalNAc或区别于三触GalNAc的递送平台,因此,对于进入这个领域的初创企业,建议针对性的进行专利分析,提前把控领域主流技术的发展情况和相应基础专利的风险,为后续产品上市做准备。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
