本期我们继续探讨基因编辑发明所涉及的创造性问题,首先我们来看一个CRISPR核心技术在中国获得专利授权的小故事。
第二个故事 让权利要求体现发明的“贡献”
案件概况
第二个故事所涉及的专利申请为CN201380038920.6,申请日2013年3月15日,发明名称为“用于RNA定向的靶DNA修饰和用于RNA定向的转录调节的方法和组合物”,申请人为加利福尼亚大学董事会和维也纳大学(没错,就是Jennifer Doudna和Emmanuelle Charpentier团队的申请)。
该专利申请是PCT申请(PCT/US2013/032589)进中国国家阶段的申请,并且在2017年7月14日获得了专利授权(授权公告号CN 104854241B)。
该专利申请涉及CRISPR技术的核心内容,主要涉及靶向DNA的RNA,其中的“蛋白质结合区段”可以与定点修饰多肽(例如Cas9/Csn1核酸内切酶)相互作用。该靶向DNA的RNA经过其中的“DNA靶向区段”,可以将结合的多肽引导至靶DNA内的特异性核苷酸序列。而其中的“蛋白质结合区段”包含彼此互补的两段核苷酸,两者可以杂交形成双链RNA双链体(dsRNA)。
该靶向DNA可以为单分子(参见下图)。
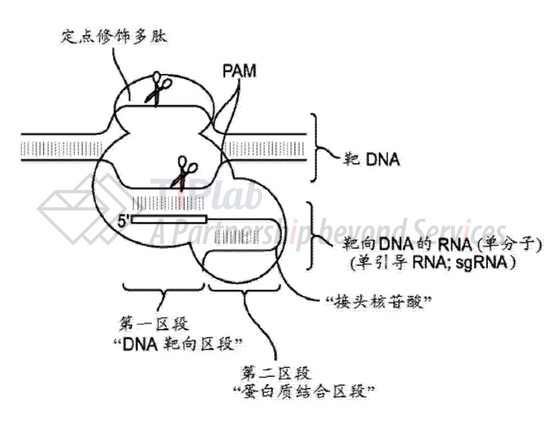
案件经过
该专利申请在PCT国际申请阶段和进中国国家阶段时的权利要求1为:
1.一种靶向DNA的RNA,其包含:
(i)第一区段,其包含与靶DNA中的序列互补的核苷酸序列;以及
(ii)第二区段,其与定点修饰多肽相互作用。
上述权利要求1请求保护的范围实际上是非常大的,任何包含与靶DNA序列互补的核苷酸序列,以及能够与所谓“定点修饰多肽”相互作用的核苷酸序列的RNA都在其范围内。然而这个“宽”的范围存在不够“新”的问题。
在PCT国际申请阶段,审查员检索了对比文件1(SASHITAL等,Mechanism of foreign DNA selection in a bacterial adaptive immune system),其涉及了一种crRNA。该crRNA包括靶DNA结合部分(即对应于上述权利要求1的第一区段)和CasA结合部分(即对应于上述权利要求1的第二区段),因此认为上述权利要求1不具备新颖性。而权利要求1的从属权利要求2限定了所述第一区段的核苷酸长度为8,也是显而易见的,不具备创造性。
那么进中国国家阶段之后审查员对权利要求1及其从属权利要求的态度又如何呢?很不幸,虽然审查员进行了检索,并引用了与国际检索报告不同的参考文献,但是审查员仍然认为上述权利要求1没有创造性。
审查员找到了对比文件1(Sapranauskas等,The Streptococcus thermophilus CRISPR/Cas system provides immunity in Escherichia coli),其涉及嗜热链球菌的crRNA被用于Cas蛋白的结合以引导入侵DNA的干扰,同时公开了Cas基因的突变(例如移码突变或缺失突变)可用于修饰Cas蛋白,因此对比文件1公开了与定点修饰的多肽相互作用的RNA。可见与对比文件1相比,上述权利要求1的区别特征在于该RNA包含与靶DNA序列互补的核苷酸序列。
对此,审查员引用了对比文件2(Deltcheva等,CRISPR RNA maturation by trans-encoded small RNA and host factor RNase III),其涉及靶DNA中的原型间隔区序列与crRNA中的间隔区来源的序列互补配对。因此对比文件2公开了crRNA包含与靶DNA中的序列互补的核苷酸序列。审查员认为,将上述对比文件1和2结合,本领域技术人员就能容易想到获得包含与DNA序列互补的核苷酸序列以及与定点修饰多肽相互作用的核苷酸序列的RNA。
审查员更进一步地检索了权利要求1从属权利要求中引用的序列,认为这些序列都是现有技术已知的序列,也无法体现出创造性。
由此可见,上述权利要求1及其从属权利要求获得授权的前途非常渺茫。此外,审查员在第一次审查意见通知书中对各个独立权利要求都给出了不具备创造性的评价。那么这个专利申请的转机在哪里呢?
在请求延期答复审查意见很久以后,申请人删除了上述的权利要求1及从属权利要求,并提交了修改的权利要求1:
1.一种修饰靶DNA的方法,所述方法包括使所述靶DNA与复合物接触,所述复合物包含:
(a)Cas9多肽,以及
(b)单分子靶向DNA的RNA,其包含:
(i)DNA靶向区段,其包含与所述靶DNA中的序列互补的核苷酸序列;和
(ii)蛋白质结合区段,其与所述Cas9多肽相互作用,其中所述蛋白质结合区段包含杂交以形成双链RNA(dsRNA)双链体的两个互补核苷酸段,
其中所述dsRNA双链体包含tracrRNA和CRISPR RNA(crRNA)的互补核苷酸,其中所述两个互补核苷酸段是通过插入核苷酸共价连接,其中所述接触为体外的或在离体细胞内;以及其中所述修饰为裂解所述靶DNA。
从“中国及多国专利审查信息查询”系统中查询可知,当申请人修改至如上的权利要求1后(2017年4月24日提交答复意见和修改的权利要求1),该专利申请随即就获得了授权(2017年5月4日发出了办理登记手续通知书)。可见,在“产品”没有授权前景的情况下,上述“方法”能够体现该专利申请的创造性。
那么申请人为何进行此修改,修改后的权利要求1为何能够快速获得授权呢,我们推测了下述几个可能的原因:
第一,将权利要求1修改至与美国同族专利申请(即US 13842859,其授权后为US10266850B1)中新增的权利要求165一致(申请人在2015年5月11日对US 13842859进行了该修改)。在2015年9月15日USPTO审查员发出的Non-Final action中,审查员直接认定权利要求165具备可专利性(is allowed),因此该权利要求有较好的授权前景。
此外,中国审查员所引用的对比文件1-4都没有涉及修改后的权利要求1的技术方案的任何内容。换句话说,对比文件1-4对该权利要求无法产生“杀伤力”。
第二,修改后的权利要求1的技术方案真正体现了相对于现有技术“做出贡献”的内容。
实施例1的结果记载“单独的成熟crRNA不能够指导Cas9催化的质粒DNA裂解,然而,添加可与crRNA的重复序列配对并且在此系统中为crRNA成熟必不可少的tracrRNA触发Cas9来裂解质粒DNA”;并且“能够tracrRNA碱基配对但含有非同源靶DNA结合序列的crRNA不能支持Cas9催化的质粒裂解”,这就证明必须通过tracrRNA:crRNA引导的Cas9才能够进行靶DNA裂解。
此外说明书记载,在单分子靶向DNA的RNA情况下,蛋白质结合区段所包含的两段核苷酸“共价连接并且杂交以形成蛋白质结合区段的双链RNA双链体,从而产生茎环结构”。
因此,修改后的权利要求1限定了使用包含tracrRNA和crRNA的单链RNA与Cas9切割靶DNA的方法中必不可少的组件和结构关系。对该专利申请而言,这也是其真正相对于现有技术(例如,已知的crRNA)做出贡献的所在。
可见修改后的权利要求1的范围与其真正的发明点是相匹配的。
第三,修改后的权利要求1限定了“体外的或在离体细胞内”,解决了该方法可能涉及“治疗和/或诊断方法”风险的问题。
TiPLaber说
本专利是利用sgRNA和Cas9进行基因编辑的方法专利,可以算是CRISPR技术在中国的重要核心专利。
一般这样重要的申请大概率会进行PCT申请,从而在不同国家存在多个同族申请。此时,审查进度较快的同族申请的审查意见可被用于参考,如果两者引用的对比文件类似或相同,则能够进一步加大可借鉴的价值(本专利的情况则是美国同族的审查员并没有引用对比文件)。可见,在某些情形下,可以考虑灵活运用“加快审查”或“延迟审查”的手段,借鉴同族申请的审查状况。
而回到本专利最终为何能获得授权的问题本身,其创造性问题是通过让权利要求体现出真正解决技术问题所需的技术方案来体现的。切割靶DNA不仅仅依靠靶向DNA的RNA,同时任意的包含DNA靶向区段和蛋白质结合区段的RNA也无法实现参与切割靶DNA的效果。而权利要求,尤其是独立权利要求必须展示相对现有技术做出贡献(换言之,所谓的发明点)所需的技术方案。这样“合适”的权利要求在实质上体现了技术效果和技术方案的统一,在说明创造性问题上也能够水到渠成。
由此可见,同族申请专利策略的整体把握和发明点的确定对后续的创造性问题至关重要,需要专业人员给出专业的参考意见。
*以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
