Dispatch的诞生
Dispatch的诞生始于一场闭门会议,四位科学家和帕克研究所负责人 Sean Parker深入讨论如何克服实体瘤免疫治疗中的种种挑战。
Dispatch 的技术源于与帕克癌症免疫治疗研究所(PICI)的关键合作以及来自 Andy Minn 医学博士(纪念斯隆凯特琳癌症中心)、Carl June 医学博士(宾夕法尼亚大学)、Chris Garcia 博士(斯坦福大学)和 Kole Roybal 博士(PICI 中心主任,加州大学旧金山分校微生物学和免疫学教授)实验室的突破性技术。
Flare平台:肿瘤特异性病毒载体 + CAR-T细胞疗法
免疫疗法治疗实体瘤的两大挑战是:缺乏肿瘤特异性靶点以及存在免疫抑制性肿瘤微环境。CAR-T疗法的应用目前也是局限于血液瘤,Dispatch 的首创 Flare 平台旨在克服这两大核心挑战,其工作原理是:
递送一种携带新型通用抗原(称为 Flare)的病毒载体,该抗原能够精确标记上皮来源的实体瘤细胞,同时破坏肿瘤的抑制性微环境。
Flare 抗原一旦进入靶点,便会像灯塔一样,引导CAR-T细胞找到并清除癌细胞,而不会损害健康组织。
癌细胞被CAR-T细胞摧毁时,数千个携带 Flare 的病毒颗粒释放到周围的肿瘤组织中,使得附近的癌细胞被标记,引发强大的连锁反应。
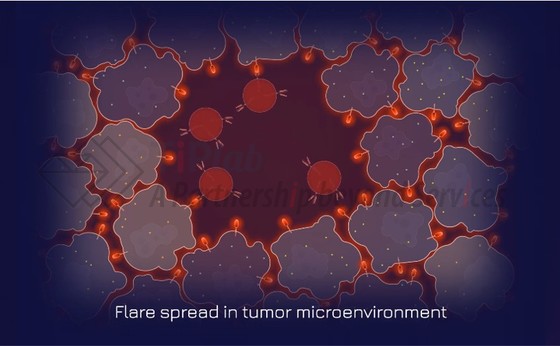
目前,Dispatch 并未具体披露关于Flare平台的更多技术细节,但是结合帕克研究所和四位科学家的研究工作,推测其中 CAR-T 具有基于逻辑门控的响应机制。
其中,Kole Roybal 的研究聚焦在使用合成生物学和化学生物学工具来设计新的合成受体,从而提升免疫细胞治疗的安全性和有效性,他拥有超过 25 项与改进细胞疗法相关的专利。
其中一个研究方向是通过定义新的组合抗原特征,利用具有合成Notch受体(synNotch) 调节回路的 CAR T 细胞增强对实体瘤的识别和治疗。2016年,在关于 synNotch 系统的开创性论文中,首次阐述了如何通过 synNotch 受体将细胞表面的抗原识别与内部转录响应逻辑链接起来,具体为,当 T 细胞上的 synNotch 受体结合目标抗原后,胞内片段(转录调控因子)被切割并进入细胞核,驱动特定基因表达(如 CAR)。
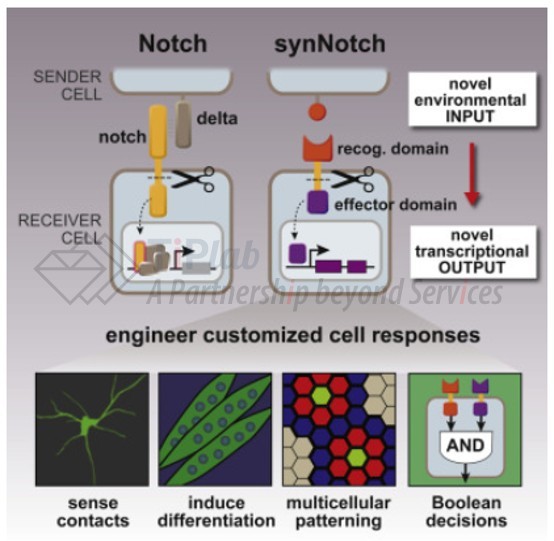
Roybal 博士还参与创建了 Cell Design Labs(后来被 Gilead 收购)与 ArsenalBio(专注于针对实体瘤的细胞疗法)。
相关专利家族PCT/US2016/019188涉及一种嵌合多肽,包括胞外结构域、Notch 受体多肽和胞内结构域。PCT/US2020/052327涉及经改进的嵌合多肽,去掉了Notch受体的负调节区。还有其他多个家族涉及嵌合受体的不同技术点,此处不一一列举。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
