辉瑞PCV13疫苗正式进入中国
肺炎球菌通过呼吸道飞沫在人与人之间直接传播,引发侵袭性肺炎球菌性疾病(Invasive Pneumococcal Disease,IPD)。发病率最高的人群是婴儿、小于2岁的儿童和老年人。
根据肺炎球菌荚膜多糖组成成分的不同,现已识别出91种血清型,引起疾病最多的一些血清型对某些抗生素耐药性已达到80%以上,导致治疗难度很大,耐药致病菌导致的感染往往是致命的。WHO(世界卫生组织)已将肺炎球菌性疾病列为需“极高度优先”使用疫苗预防的疾病。
13价肺炎多糖结合疫苗(PCV13疫苗)是全球使用最为广泛的肺炎球菌多糖结合疫苗,也是唯一一款用于全年龄组人群注射的肺炎疫苗,全球仅辉瑞一家生产,目前13价肺炎疫苗已经进入全球100多个国家的免疫规划当中。辉瑞的PCV13疫苗被称为全球“疫苗销售之王”,2017年全球销售额高达57亿美元。
2016年11月2日,辉瑞的PCV13疫苗正式获得中国国家食品药品监督管理总局的进口药品注册证,被批准用于帮助6周龄至15月龄婴幼儿预防由13种肺炎球菌导致的相关侵袭性疾病,如菌血症肺炎、脑膜炎、败血症和菌血症等。
这是继2015年4月辉瑞7价肺炎多糖结合疫苗(PCV7)在中国许可证过期后,辉瑞肺炎疫苗在中国的首次回归,弥补了中国市场上2岁以下婴幼儿肺炎疫苗的空白。
在中国,PCV13疫苗是需自费接种的二类疫苗,单剂价格约为700元,全程接种四剂次价格约为2800元,其较高的价格还是让很多普通家庭望而却步。
辉瑞PCV13疫苗核心专利被无效
巨大的市场空间使得国内外多家医药公司垂涎三尺,辉瑞的PCV13疫苗的专利壁垒遭到了一系列的攻击。
一纸无效宣告请求
事情要从2015年1月14日中国专利复审委员会收到的一纸无效宣告请求说起。
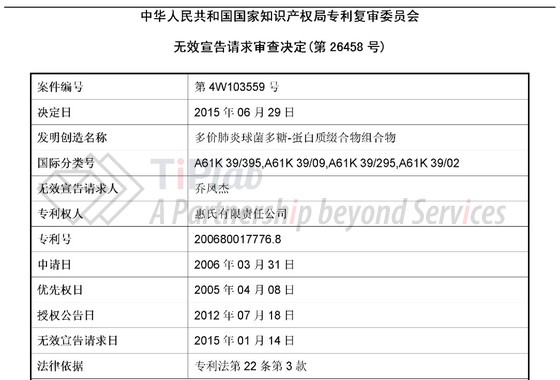
这次无效宣告请求针对的是为PCV13疫苗保驾护航的一件组合物核心专利,发明名称为“多价肺炎球菌多糖-蛋白质共轭物组合物”(CN200680017776.8),其优先权日为2005年4月8日,申请日为2006年3月31日,授权日为2012年7月18日。涉案的权利要求1如下:

无效请求方提交的关键证据(CN1351501A,公开日为2002年5月29日)则披露了一种包含13价肺炎球菌荚膜多糖血清型抗原的疫苗组合物,所述13价血清型包括1、3、4、6A、6B、7F、9V、14、18C、19A、19F和23F肺炎链球菌荚膜多糖。
可见权利要求1与证据1的区别技术特征在于采用了CRM197作为载体蛋白制备13价疫苗组合物,而证据1优选PD作为单一载体蛋白。
双方争议的焦点
无效请求方认为:
权利要求1不符合专利法第二十二条第三款的规定,也就是“缺乏创造性”。
其具体理由是:
根据证据1以及其他多篇现有技术记载,CRM197是一种常用的载体蛋白,并且证据1优选PD作为单一载体蛋白的原因仅仅在于对预先接种过白喉类(DT)和破伤风类毒素(TT)疫苗的患者,如果使用CRM197作为载体蛋白,会产生表位抑制现象,由于多数儿童患者接受过DT和TT疫苗,所以不宜采用CRM197。但是针对没有预先接种DT和TT疫苗的人员,本领域技术人员仍会选择采用CRM197作为载体蛋白。
也就是说,证据1中对CRM197缺点的描述并不足以使本领域技术人员舍弃CRM197这个常用载体的普遍认知和教导。
辉瑞认为:
证据1在说明书中已经明确教导,为减小表位抑制的不利影响,应该避免使用包括CRM197在内的常用载体蛋白,尤其避免单独使用CRM197载体,同时证据1反复强调使用PD作为载体蛋白可以减小表位抑制,因此证据1给出了与涉案专利权利要求1相悖的启示。
此外,涉案专利的实施例已经表明,采用CRM197作为载体蛋白时,13价疫苗成功激发了免疫应答,而且降低了表位载体抑制现象,因此权利要求1取得了预料不到的技术效果,具备创造性。
复审委宣告涉案专利全部无效
复审委站在了无效请求方的一边,其认为辉瑞声称的“降低了表位载体抑制现象,取得了预料不到的技术效果”,因缺乏说明书中相应实施例的记载而不被支持。
在涉案专利的实施例中,采用CRM197作为载体蛋白的实验对象均为兔,而不是预先接种了DT和TT疫苗的人群,因此涉案专利的数据无法证明,采用CRM197作为载体蛋白时表位抑制现象不存在。
而根据表位抑制产生的原理,对于预先接种了DT和TT疫苗的人群,涉案专利以CRM197作为载体蛋白的13价疫苗仍然可能存在表位抑制现象。
此外,涉案专利说明书还记载其他白喉类毒素、破伤风毒素、百日咳类毒素、匙孔血蓝蛋白等也适用于涉案专利,可以用作肺炎链球菌荚膜多糖缀合的蛋白载体。
由此可见,涉案专利说明书并没有关于为了减小表位抑制而特定选择以CRM197作为载体蛋白的任何记载。
最终,复审委宣告涉案专利的全部无效。
正如复审委在无效决定里强调的那样,如果专利权人仅仅是声称取得了“预料不到的技术效果”,而在说明书中没有公开相关的效果情况,则专利权人声称的技术效果和技术问题不能作为判断专利权创造性的依据。
可见,SIPO当前的审查标准对于“创造性”的要求非常高。相应地,对申请文件的撰写、以及撰写前的准备工作也提出了更高的要求。
辉瑞PCV13疫苗专利家族的其他成员
涉案专利的分案申请
对涉案专利CN200680017776.8,辉瑞还提出过分案申请CN201210192553.2,但是该分案申请在2017年10月10日遭到了驳回。
目前,CN201210192553.2的分案CN201510187769.3和CN201810299488.0还处于在审状态,但是经历了上述的无效和驳回后,这两个分案申请能否顺利获得授权,已然是一个大问题。
辉瑞公司不断地提分案,一方面可能是还想争取到授权的可能性,另一方面是把分案申请作为专利布局战略的手段之一,可以达到为竞争对手设置障碍的威慑作用。
制剂专利
对于如此重要的PCV13疫苗,辉瑞自然为其进行了全面的专利布局。
然而,目前辉瑞与PCV13疫苗相关的制剂专利申请CN201180027663.7已经被驳回,CN201180027663.7的分案申请CN201710133332.0目前处于在审状态,前途依旧未卜。
制备方法专利
虽然PCV13疫苗还有相关的制备方法专利ZL200780051661.5和ZL201310511943.6已经被授权,它们的专利权期限至2027年12月10日,但是相比于组合物和制剂这样的产品发明专利,制备方法专利在实践过程中存在侵权举证难和侵权责任判定难等问题,因此保护力度相对较弱。
因此,经历此次无效案件,可以说辉瑞在PCV13疫苗领域元气大伤。
新的市场格局,我们拭目以待
辉瑞在它如此重要的PCV13疫苗的核心专利上遭遇了重击,给予潜在竞争者更大的发挥空间。本次专利无效纠纷给我们带来一些思考:
一方面,基于当前的审查实践,专利申请的撰写需要慎之又慎,“预料不到”的技术效果需要在说明书中有扎实记载;
另一方面,专利申请的布局需层层递进,不仅需要在研发的初期申请基础性的化合物核心专利,而且对于成熟的产品,可能需要延伸性的布局来逐步巩固专利组合的稳定性。
对于PCV13疫苗肺炎疫苗市场,新的市场格局已初见端倪:
目前仅中国医药公司,就有沃森生物、民海生物、兰州生物制品研究所、北京科兴生物和成都安特金生物等在研发PCV13疫苗,其中沃森生物的PCV13疫苗在今年3月28日已经进入优先评审通道,民海生物目前处于III期临床,兰州生物制品研究所处于II期临床。
让我们拭目以待崭新的竞争格局!
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
